Есть в мире нечто, стоящее больше материальных удовольствий,
Огюстен Тьерри, французский историк
больше счастья, больше самого здоровья – это преданность науке.
С термином «прионы» человечество встретилось в конце ХХ, начале XXI веков благодаря беспрецедентной по размерам эпизоотии (вспышке заболевания животных), так называемого «коровьего бешенства» в Великобритании.
Оказалось, что это заболевание вызывает инфекционный агент, получивший название прион - инфекционный протеин (белок). Повышенная озабоченность проблемой прионовых заболеваний была вызвана возможностью угрозы здоровью людей, которые потребляли мясо инфицированных животных и, особенно, их мозг.
Название «коровье бешенство» не совсем верно, поскольку им болеют преимущественно овцы и козы. Эта болезнь овец и коз известна в Великобритании с давних времён, с 1732 г. Больные животные страдают от сильного зуда, становятся возбужденными или, наоборот, вялыми, у них нарушается координация, и через несколько месяцев животные погибают. Инкубационный период болезни - 2–5 лет. Эту болезнь в Великобритании назвали scrapie, скрейпи, что означает «царапать», «чесать». Русский аналог - почесуха.
Более 200 лет о скрейпи не было известно почти ничего, пока в 1935 г. французские учёные не установили её инфекционность.

передаваться и крупному рогатому скоту,
вызывая развитие энцефалопатии (воспаление
мозга), а также оленям и лосям, вызывая
у этих животных хроническую
изнурительную болезнь

Для скрейпи показана возможность заражения животных внутримозговым, сосудистым, внутримышечным, внутрикожным, подкожным, а также пероральным способами. Последний способ объясняет феномен существования «заразных пастбищ», когда здоровый скот, находясь на пастбище, где перед тем находилось больное стадо, тоже начинал болеть.
В организме больных животных возбудитель обнаружен в основном в головном мозге, а также в лимфатических узлах, селезёнке, спинномозговой жидкости. Через заразные пастбища скрейпи может передаваться и крупному рогатому скоту, вызывая развитие энцефалопатии (воспаление мозга), а также оленям и лосям, вызывая у этих животных хроническую изнурительную болезнь.
Поэтому понятно, что эта эпизоотия вызвала негативную реакцию жителей Европы в конце ХХ века, поскольку возникла угроза получить ещё дополнительную болезнь, связанную с нарушением центральной нервной системы у людей. На вывоз мясной продукции из Великобритании был введён карантин, и было запрещено употребление головного мозга животных.
Через несколько лет эпизоотия «коровьего бешенства» прошла, о скрейпи и прионах начали забывать. Возникли другие риски, связанные с вирусными заболеваниями, но относиться пренебрежительно к прионовым болезням не следует, поскольку они не преодолены. Прионы продолжают вызывать болезни как у животных, так и у людей.
Наиболее распространённой болезнью людей, подобной скрейпи животных, является болезнь Крейцфельда–Якоба (БКЯ, англ. Creutzfeldt-Jakob disease, CJD), которая была выделена как отдельное заболевание в 1920–1921 гг.
Это редкое прогрессирующее заболевание коры головного мозга, базальных ганглиев и спинного мозга, которое заканчивается летально. Менее распространены синдром Герстмана–Штрауслера–Шенклера, «куру», фатальная семейная инсомния (бессонница). Все приведенные болезни долгое время считались чисто наследственными. Но сейчас окончательно доказано, что эти болезни и людей, и животных вызываются одним и тем же инфекционным агентом, прионами, и все они объединяются в группу так называемых подострых, трансмиссивных губчатоподобных энцефалопатий.
Откуда же появился термин «прионы», кто автор, и что он означает? Именно об этом и пойдёт речь дальше.
Термин «прионы» был предложен американским учёным Стэнли Прузинером, который как раз и установил инфекционность этих протеиновых (белковых) соединений. Кто же такой этот учёный и что за сенсационное открытие он сделал, получив в 1997 году Нобелевскую премию по физиологии и медицине в возрасте 55 лет.
С ним и с его исследованиями, связанными с уникальными болезнями людей и животных, мы вас и познакомим.

американский врач, профессор неврологии
и биохимии Университета Калифорнии
в Сан-Франциско, лауреат Нобелевской премии
по физиологии и медицине 1997 года
Итак, начнём. Американский биохимик и невролог, трёхкратный профессор (по неврологии, вирусологии и биохимии) Прузинер Стэнли Бенджамин (англ. Stanley Benjamin Prusiner, 28.05.1942 г.) родился в Де-Мойн (штат Айова) в семье еврейских эмигрантов из Российской империи Лоренс (Лоуренс ) и Мириам (Спигель) Прузинер. Его отец был архитектором, во время Второй мировой войны служил в ВМС США и участвовал в испытании первой американской водородной бомбы.
Но Стэнли не пошёл по стопам отца, он выбрал другую профессию. После окончания средней школы он поступил в Пенсильванский университет, где заинтересовался химией и стал бакалавром по химии. Продолжил обучение Стэнли в Медицинской школе при том же университете, где получил степень доктора медицины.
В 1972 году он занял должность ординатора-невролога в Медицинской школе Калифорнийского университета в Сан-Франциско. В 1980 г. С. Прузинер стал профессором неврологии, а в 1988 г. - профессором биохимии этого же университета. Именно работая в Калифорнийском университете Стэнли Прузинер заинтересовался поиском инфекционного агента, вызывающего энцефалопатии, такие, как болезнь Крейцфельда–Якоба. В то время считали, что таким агентом является вирус, и молодой невролог начал искать такой вирус.
Чтобы оценить современное значение работы С. Прузинера, следует окунуться в историю. Ещё задолго до его рождения, в 1920 г., немецкий нейрофизиолог Ганс Герхард Крейцфельд (правильнее Кройцфельд, нем. Hans-Gerhard Creutzfeldt) описал необычное заболевание у людей: нарушение поведения, зрения и координации движений, эпилептические приступы и, как следствие, смерть. Через год его соотечественник и коллега, невропатолог Альфонс Мария Якоб (нем. Alfons Maria Jakob) также описал подобное заболевание и связал его с поражением рогов спинного мозга и пирамидальной системы.
Так мир узнал о губчатой энцефалопатии, получившей название болезнь Крейцфельда–Якоба (БКЯ) у людей, а у животных - коровье бешенство, или скрейпи (почесуха) - болезнь овец и коз. При всех этих болезнях в нервных клетках образуются токсичные амилоидные сфероиды и фибриллы (агрегаты), так называемые нерастворимые «бляшки». Как позднее выяснилось, такие «бляшки» являются фактически протеинами (белками). Но об этом пойдёт разговор позже.
Следующим исследователем таких болезней у людей был американский педиатр и вирусолог словако-венгерского происхождения Даниэл Карлтон Гайдушек (англ. Daniel Carleton Gajdusek).
В 1957 г. он обследовал здоровье детей и взрослых аборигенов Австралии и Новой Гвинеи, которые в то время находились под австралийским протекторатом. Там он познакомился с Винсентом Зигасом (англ. Vincent Zigas), работником австралийской службы здравоохранения. Последний рассказал Д. Гайдушеку о необычном племени форе, людей, живущих высоко в горах Новой Гвинеи и развитие которых находится на уровне каменного века.
Многие члены этого племени страдают смертельным дегенеративным заболеванием мозга, который они называют «куру» и которое никем не было исследовано. Слово «куру» переводится как «тряска, дрожание» или «порча». Вместе с В. Зигасом Д. Гайдушек провёл на территории такого племени почти год, овладел их языком и изучал необычное заболевание - «куру».
Д. Гайдушек и В. Зигас сначала считали, что «куру» вызывается вирусом. Но они не смогли выделить болезнетворный агент или вызвать заболевания у животных традиционными вирусологическими методами. Поскольку болели, как правило, члены одной семьи, учёные предположили сложную генетическую природу заболевания.
В 1959 г. специалист по заболеваниям нервной системы у животных Уильям Хадлоу проанализировал результаты их исследований «куру» и установил, что эта болезнь подобна «почесухе», дегенеративному заболеванию овец.
«Почесуха» («скрейпи») характеризуется исключительно долгим инкубационным периодом, как правило, проходят годы между заражением животных и появлением у них определённых симптомов заболевания. Поэтому возбудителя такого заболевания исследователи назвали «медленный вирус». Хотя эта болезнь передавалась от одного животного к другому, вирус «почесухи» также не был обнаружен традиционными вирусологическими подходами.

из уважения к умершему,
использовали в пищу его мозг

Д. Гайдушек предположил, что передача заболевания «куру», как и скрейпи животных, также может происходить «медленным вирусом». Дело в том, что в племени форе имел место ритуальный каннибализм: после смерти родственника члены его семьи, из уважения к умершему, использовали в пищу его мозг. Такой путь обеспечивал прямой перенос вируса от умершего больного к здоровому человеку.
В 1963 г. Д. Гайдушек начал эксперименты с пересадкой ткани головного мозга людей, погибших от «куру», человекообразным обезьянам. Через два года у экспериментальных животных появились признаки заболевания «куру». Сначала Д. Гайдушек ставил опыты на шимпанзе, но потом перешёл и на низших обезьян. Во всех случаях последствия были положительными - животные заболевали «куру».
Достигнутые успехи поставили перед Д. Гайдушеком и его коллегами вопрос поиска таких «медленных вирусов». В 1971 г. было установлено, что болезнь Крейцфельда–Якоба (БКЯ), симптомы которой похожи на «куру», может передаваться и животным.
Проведенные Д. Гайдушеком исследования «почесухи», «куру» и БКЯ показали, что все эти болезни имеют ряд общих черт. Все они с длинным инкубационным периодом и, в отличие от вирусов, не дают типичной иммунной реакции: воспаления, повышения температуры, выработки антител и интерферона и др.
В отличие от обычных вирусов, в их строении не было обнаружено ни молекул ДНК, ни РНК даже при использовании электронного микроскопа. «Медленные вирусы» не инактивировались такими традиционными средствами, как формальдегид, ультрафиолетовые лучи, высокая температура, что разрушает обычные известные вирусы.
Все приведенные факты убедили Д. Гайдушека и других учёных в том, что «медленные вирусы» являются принципиально новым болезнетворным агентом, а именно инфекционным протеином (белком). Оставалось непонятным, чем именно вызвано образование этих инфекционных соединений, аномальных по форме и по количеству клеточных протеинов. Оказалось, что протеиновые тяжи (или бляхи) находятся и в мозгу людей с болезнью Альцгеймера, а также тех пожилых людей, которые страдают старческим слабоумием.
Результаты таких работ не остались незамеченными в научном мире. В 1976 г. Даниэль Карлтон Гайдушек был удостоен Нобелевской премии по физиологии и медицине одновременно с Барухом Самуилом Бламбергом (американским врачом и учёным, англ. Baruch Samuel Blumberg) «за открытие новых механизмов происхождения и распространения инфекционных заболеваний».
Б.С. Бламберг награждён премией за исследование вируса гепатита и за то, что получил данные о возможности образования рака печени у людей после заражения вирусом гепатита В.
Д.К. Гайдушек был награждён не за то, что открыл происхождение болезни «куру», а за то, что его исследования привели «к распознанию новой категории человеческих болезней, вызываемых уникальными инфекционными агентами», - сказал в приветственной речи при присуждении премии Эрлинг Норби из Каролинского института.
А теперь вернёмся к работам Стэнли Прузинера. Как мы уже отметили выше, он столкнулся с «медленным вирусом» в 1972 г., когда стал работать в отделении неврологии Калифорнийского университета (Сан-Франциско). Через два месяца после начала работы у него умерла пациентка от необратимых повреждений, вызванных болезнью Крейцфельда–Якоба (БКЯ).
В то время учёные и врачи не были уверены, что эту болезнь вызывают именно вирусы. И амбициозный молодой врач решил установить молекулярную структуру возбудителя БКЯ. После детального изучения литературы С. Прузинер в 1974 г. открыл собственную исследовательскую лабораторию. Но первая статья о выделении нового агента - протеина приона - вышла только в 1982 г. И именно С. Прузинер является автором термина «прион».
Это название состоит из английских слов: protein infections agent - протеиновая инфекция или инфекционный протеиновый агент. Автор ещё назвал его «прион» - PrP (Prion Protein). Получение такого прионового (белкового) соединения в чистом виде позволило определить его аминокислотную последовательность, а в 1985 г. идентифицировать соответствующий ген PrnP, кодирующий прион.
Статья вызвала бурю в медицинских кругах - медицина вообще консервативна, но утверждать, что болезнь передаётся только протеинами - такого не может быть! Немногие учёные приняли эту концепцию сразу. Даже Д.С. Гайдушек так и не признал открытие С. Прузинера до самой смерти в 2008 г.
А наука продолжала развиваться. В 1997 г. С. Прузинер был награждён Нобелевской премией по физиологии и медицине за сенсационное открытие в области биохимии белков и инфекционных болезней - «за открытие прионов, нового биологического принципа инфекции». Фактически С. Прузинер открыл новую, неизвестную до сих пор, страницу в биологической и медицинской науке.
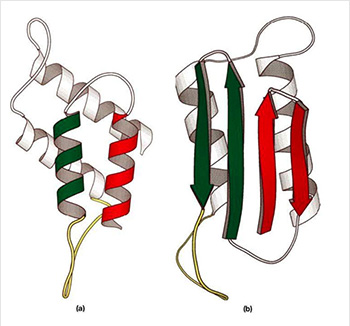
(а) – Нормальная конфигурация: Представлена
трёхмерная структурная модель PrPC, которая имеет
четыре α-спирали. Эта модель хорошо согласуется
с мутациями, не вызывающих
наследственных болезней.
(b) – «Патологичная» конфигурация: Представлена
трёхмерная структурная модель PrPSc, которая имеет
четыре β-слоя (на переднем плане) и
2 α-спирали (на заднем плане)
В своей речи после вручения Нобелевской премии С. Прузинер сказал: «Так называемые конформационные болезни обусловлены трансформацией α-спиральных участков молекул протеина в β-структуры (листья) с последующей агрегацией и полимеризацией таких молекул в токсичные для клеток амилоидные сфероиды и фибриллы (внутриклеточные депозиты, «бляшки»). Список протеинов, способных к формированию амилоидных агрегатов, постоянно расширяется. Наиболее известными являются β-амилоид и тау-протеин (болезнь Альцгеймера), прионовый протеин БКЯ, α-синуклеин (болезнь Паркинсона), хантингтин (болезнь Хантингтана), β-микроглобулин (диализный амилоидоз). Амилоидозы развиваются медленно, часто десятилетиями, и они делятся на неинфекционные («возрастные» нейродегенеративные заболевания) и инфекционные - трансмиссивные спонгиоформные (губчатые) энцефалопатии - это прионовые болезни куру, БКЯ, скрейпи (почесуха) овец и другие. Прионными также являются наследственные заболевания - такие, как синдром Герстмана–Штраусслера–Шенклера и фатальная семейная бессонница».
Через некоторое время стало ясно, что прионы - это не новая форма жизни, они являются собственными белками человека и становятся патогенными благодаря изменению их третичной структуры (конформации). Эти изменения могут быть вызваны различными факторами - от внешнего воздействия до генетических мутаций.
Почти через десять лет после первой обзорной работы (1982 г.) С. Прузинер опубликовал большую итоговую статью в журнале «Science» (1991 г.) - «Молекулярная биология прионовых болезней».
Что же собой представляют прионы и в чём заключается их инфекционность?
Возбудитель прионовых болезней - это мутантная (инфекционная) форма обычного, нормального протеина. Последний синтезируется во многих клетках, но наиболее активно в нервной ткани - это прионовый протеин млекопитающих, который С. Прузинер назвал PrPC (также PrPC, где верхний индекс «С» - cellular, клеточный).
Этот «нормальный» прион может переходить в патологическую форму - PrPSc (также PrPsc, где «sc» от английского слова scrapie), которая легко агрегирует, образуя бляшки, устойчива к протеолитическим энзимам (ферментам) - протеиназам, а также к различным физическим факторам и возникает либо спонтанно, либо при контакте с такой же формой - PrPsc. Но контактировать должны протеины с подобной аминокислотной последовательностью, поэтому случаев заражения между видами обнаружено мало.
Биологически активный, «инфекционный прион» (PrPsc) мало чем отличается по аминокислотной последовательности от обычного, клеточного PrPc. Тогда благодаря чему же нормальный клеточный, низкомолекулярный протеин (PrPc) становится «инфекционным»?
Выяснилось, что всё обусловлено разницей в третичной структуре этих двух протеинов. Если нормальный клеточный прион в своём строении имеет четыре α-спирали и не имеет β-слоёв, то в «инфекционном» есть четыре β-слоя и две α-спирали. Поэтому последний является структурой гидрофобной, на него не действуют протеиназы (протеолитические энзимы), и его молекулы способны взаимодействовать между собой, образуя агрегаты («бляшки», «тяжи»).
Что провоцирует превращение нормальных протеинов, выполняющих, пожалуй, важные функции в клетках (возможно, связанные с клеточным циклом или врождённым иммунитетом), в патогенные пока окончательно не известно. Считается, что «инфекционность» прионов и других амилоидных белков проявляется только вместе с другими молекулами, которые помогают превращаться нормальным протеинам в патогенные, например, с нуклеиновыми кислотами или гликозаминогликанами.
Вообще, протеины, которые способны к агрегации, встречаются не только у млекопитающих, их эволюционные корни достигают древности. Так, амилоидные агрегаты обнаружены у дрожжей и у мицеллярного гриба, но особых цитологических и инфекционных свойств они в них не обнаруживают.
Таким образом, в конце нашего рассказа следует отметить, что благодаря исследованиям ряда врачей и учёных во второй половине ХХ века сделано сенсационное открытие в области биологии и медицины - обнаружены и исследованы протеины-прионы, вызывающие такие болезни, как спонгиоформные нейродегенеративные энцефалопатии у людей и животных.
Особо следует отметить выдающиеся работы двух Нобелевских лауреатов - Д. Гайдушека и С. Прузинера. Открытия этих учёных имеют большое теоретическое значение для биохимической и медицинской науки именно потому, что они впервые установили тот факт, что конформация (структура) протеина прионов является носителем определённой биологической информации, а именно – инфекционности, вопреки основному постулату молекулярной биологии о том, что наследственная информация передаётся только при участии нуклеиновых кислот. Прионы - это не экзотический случай, а общебиологическое явление.
Прионовая проблема выходит за рамки только биохимической экзотики, она остаётся одной из «горячих точек» современной биохимии, молекулярной биологии и медицины и ставит ряд теоретических и практических задач, требующих и сейчас немедленного решения, в первую очередь, создания эффективных лекарств, действие которых направлено на место расположения болезненного агента в организме человека и животных.
Проблемы XXI века также будут преодолены, и это касается не только коронавируса COVID-19, но и других болезней, благодаря светлому уму именно таких талантливых учёных, о которых мы вам рассказали в этой статье.
А завершить рассказ о прионах хочется словам самого Стэнли Прузинера: «Люди часто спрашивают меня, почему я занялся исследованием такой сложной проблемы. Я обычно отвечаю, что всего лишь нескольким учёным выпала большая удача исследовать научные темы, настолько новые и необычные, что только небольшое количество людей может оценить значение таких открытий с самого начала. Я - один из тех, действительно «удачливых» учёных, которому выпала возможность работать именно над такой проблемой - проблемой прионов».
Р.П. Виноградова, доктор биологических наук, профессор,
В.М. Данилова, кандидат биологических наук,
Е.Г. Виноградова, кандидат биологических наук


 Основатель и издатель
Основатель и издатель Copyright © 2016–2021 Научно-популярный
Copyright © 2016–2021 Научно-популярный