
Продолжение рассказа об атомной гипотезе, – идее, возникшей немало тысячелетий тому назад, – начнем с несколько, быть может, неожиданного утверждения. «Атомизм» предполагает, что всё, из чего состоит окружающий нас мир, построено из отдельных квантов, порций, атомов. Имеются в виду не только тела, но и отдельные их свойства.
Но вспомним, что всё, с чем имеет дело человек, основано сначала на бытовых, а позже и специально задуманных опытах, которые имеют определённую точность. И даже без особых рассуждений или идей об атомном устройстве мира человеческие представления о природе изначала квантованы этой самой точностью, погрешностью измерений.
Например, длина тетради, измеренная линейкой (пусть эта длина примерно 20 см), в зависимости от точности её измерений, может принимать при погрешности 1см – не более 20 значений, при погрешности 5 см – не более 4 значений, а «линейка» с погрешностью в 30 см нашей тетради вообще не заметит.
Тут возможно возражение. У каждого человека свой набор границ точности разных измерений, и ведь это разные представления о мире. А идея атомизма как бы обобщает эти разные точности на одну самую точную.
Но заметим, что эта самая наивысшая для человека точность не дана свыше, она меняется с совершенствованием орудий труда, точности приборов измерения. Поясним эту мысль на примере.
Так, Аристотель считал, что величина силы пропорциональна скорости тела, которую оно приобретает под действием этой силы. Галилей размышлениями и опытным путем пришёл к другому выводу: сила вызывает изменение скорости, то есть ускорение. Как можно объяснить такое расхождение? Ведь, на первый взгляд, прав Аристотель. Любое тело, будучи предоставлено самому себе, рано или поздно остановится (если на него не действует какая-нибудь сила).
Можно объяснить так. Галилей пользовался более точным прибором для измерения, в частности, времени. Есть предположения, что он измерял время не с помощью простого маятника (шарика, подвешенного на нитке) с периодом секунда, а использовал колебания струны с гораздо меньшим периодом, чем у такого маятника. Не говоря о том, что Галилей проводил математический анализ своих наблюдений.

(1608–1647)
Другой пример, в котором точность измерения сыграла решающую роль, у нас уже был об этом подробный рассказ, – открытие «колец Ньютона» Эванджелиста Торричелли (1608–1647), учеником Галилео Галилея, который использовал это явление для повышения до микронной точности обработки линз.
Правда, отметим (напомним), что кольца носят имя Ньютон вполне заслуженно. Эту точность он сумел обеспечить с помощью несложной математики. Погрешность оказалась равной половине длины волны света.
Интересно, что обобщающие законы как раз и возникают при расширении возможностей эксперимента. Притом, что в более узкой области оказывается справедливым «приближённый» закон.
Здесь поясню, почему слово приближённый взято в кавычки. Каждый уровень точности, вообще говоря, является вполне самодостаточным. То есть, имея набор приборов определённой точности, вы в принципе не сможете проверить факты, наблюдаемые при более точных измерениях.
Попытки построить окончательную теорию, типа теории всего, неосознанно основаны на вере в существование абсолютной точности, которая в действительности человеку недоступна. Трудности любой теории начинаются как раз у порога разрешения используемых для её подтверждения приборов.
Иллюзию возможности абсолютно точного знания подкрепляет анализ бесконечно малых Ньютона–Лейбница с понятием непрерывности, которое лежит в основе большинства физических теорий. Но, к сожалению, другой математики, адекватной наблюдению, учёные пока не придумали.
Может показаться, что мы отклонились от темы и всё сказанное – какая-то «философия», не имеющая никакого отношения к теории квантов. Прежде всего, точнее будет термин размышление. И, надеюсь, очень скоро будет видно, что отношение этого к теме – самое прямое.
В связи с точностью или, другими словами, разрешением используемых в опытах приборов, историю спектров можно условно разбить на три этапа. До Г. Галилея, потом до ХIХ века и с начала ХХ века по настоящее время.
Здесь мы коснёмся только первых двух этапов, о третьем поговорим отдельно. Первый этап зародился ещё в глубокой древности. Уже древние гончары, задолго до исследований теплового излучения, знали о зависимости цвета тела от степени его нагретости (температуры). Римляне знали о способности призмы создавать радугу цветов.
Пропустим эпоху корпускулярных представлений о свете Ньютона и перейдём сразу ко второй половине ХIХ века. Уже было хорошо известно, что нагретые тела и жидкости излучают электромагнитные волны с непрерывным спектром.
Под спектром понимают набор электромагнитных волн из некоторого интервала длин волн или же дискретное количество таких волн. Те учёные, которые придерживались атомных представлений, не сомневались, что излучение нагретых тел и жидкостей обусловлено колебаниями атомов и молекул и их взаимодействием друг с другом.
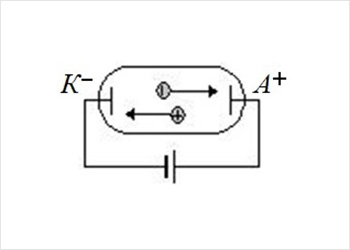
К–, А+ – катод и анод
Немного остановимся с историей и поясним, почему столько внимания мы уделяем спектрам. Ответ простой: именно в спектроскопии возникли первые парадоксы неклассического поведения тел, излучающих электромагнитные волны.
Исследование атомных спектров началось в 1860 г., когда немецкие учёные Густав Кирхгоф (1824–1887) и Роберт Бунзен (1811–1899) опубликовали работу «Химический анализ с помощью наблюдений спектра». Уже в 1870 году английский физик Джонстон Стони (1826–1911), тот, кто дал имя электрону и первым, изучая электролиз Фарадея, оценил величину минимального заряда в 10–20 Кл, наблюдал дискретный спектр излучения разреженного газа.
Именно здесь и начались парадоксы, которые позже привели к теории квантов.
Если нагреть разреженный газ, например, приложив высокое напряжение, то его атомы возбуждаются и, переходя в устойчивое состояние с более низкой энергией, излучают свет, схема опыта показана на рис. 1. Но спектр у такого газа не был непрерывным, он оказался дискретным или линейчатым.
Причём каждый элемент (или соединение) обладал своим, присущим только ему, спектром испускания. Этот спектр мог служить своего рода «отпечатком пальцев» и позволял определять наличие в веществе того или иного элемента.
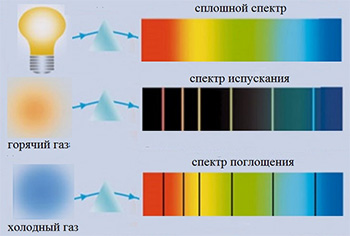
разного типа
Если излучение с непрерывным спектром, например, из печи, пропустить через разреженный газ, то в его спектре появятся тёмные линии, соответствующие светлым линиям в линейчатом спектре испускания данного газа. Такой спектр (с темными линиями) назвали спектром поглощения. Так установили, что газы поглощают свет на тех же частотах, на которых они его излучают, см. рис. 2.
Обратим внимание, что линейчатый спектр испускания или поглощения газа наблюдается при малой его плотности (примерно 150 Па, атмосферное давление около 100 000 Па). В таком газе атомы в среднем находятся на больших по сравнению с размером атома расстояниях друг от друга.
Это указывало на то, что свет испускают или поглощают изолированные атомы, а не их группы, взаимодействующие между собой в твёрдых телах, жидкостях или плотных газах. Но как объяснить такое необычное поведение излучающих атомов. Классические теории не давали никаких намёков на решение этой загадки.

(1814-1874)
В создании науки о спектрах, которая обеспечила физику сверхточным инструментом исследования, принимали участие многие замечательные учёные. Это – Афанасий Кирхер, 1646 г.; Ян Марек Марси, 1648 г.; Роберт Бойль, 1664 г.; Франческо Гримальди, 1665 г.; наконец Исаак Ньютон, 1666–1672 гг. Немного позже спектрами занимались Вильям Волластон, 1802 г.; Йозеф фон Фраунгофер, 1815 г.; Джон Гершель и Уильям Талбот, 1820 г.; Дж. Фукальт, 1849 г. и другие.
Подробнее скажем о выдающемся шведском физике Андерсе Ангстреме (1814-1874). О том самом, в честь которого названа единица длины 1 Ангстрем = 0,1 нанометра. Для нас интересен тот факт, что эта единица примерно равна размеру атома водорода. Среди прочих его достижений – проведение сверхточных измерений линейчатого спектра разреженного газа водорода. Он изучил четыре линии, которым даже присвоили специальные обозначения Нα, Нβ, Нγ, Нδ.
С начала исследований светового спектра учёным стало понятно, что, несмотря на кажущийся беспорядок, линии спектра подчиняются некоторой закономерности. Первым точное соотношение здесь установил тот же Дж. Стони (1870 г.). Учитывая, что частоты линий спектра водорода связаны с длиной волны соотношением
|
ν = с/λ, |
(1) |
где ν – частота света, с – его скорость и λ – длина волны, для частот линий он получил соотношение:
|
Нα: Нβ: Нδ = 20: 27: 32. |
|
Это наталкивало на мысль, что эти линии связаны с каким-то периодическим процессом в атоме водорода.
Дальше история спектров связана с удивительным открытием. Скромный преподаватель физики и математики из г. Базель (Швейцария) Иоганн Бальмер (1825–1898) нашёл простое соотношение, которое описывало не только результаты Стони, но целую серию таких линий. Вот эта формула
|
λ = bn2/(n2 – 4), |
(2) |
где b = 364,56 нм – эмпирическая постоянная, а n = 3, 4, 5, … целые числа. Как он пришёл к своей формуле остаётся загадкой.
Говорят, Бальмер был сторонником античной пифагорейской школы, в которой гармонию природы связывали с мистической ролью целых чисел. Но сторонником какого философского течения он бы ни был, как он нашёл эту формулу? Ведь это не просто разделить одно число на другое, как в случае Стони.

(1825–1898)

(1854–1919)

(1885–1962)
Чтобы вы могли оценить поражающее воображение совпадение измеренных и вычисленных значений длин волн, приведём данные измерения длины волны линий Ангстремом и вычисленные по формуле Бальмера (2):
| Ангстрем | Бальмер | n | |
| 656,210 | 656,208 | 3 | красный |
| 486,074 | 486,080 | 4 | сине-зелёный |
| 434,010 | 434,000 | 5 | синий |
| 410,120 | 410,130 | 6 | фиолетовый |
Как видите, ошибка в 4–5 десятичном знаке. В 1890 году шведский физик Иоганн Ридберг (1854–1919) предложил записывать формулу в виде, который используют и сегодня, через частоты:
|
ν = cRλ(1/k2 – 1/n2), |
(3) |
где k и n – целые числа (в серии Бальмера k = 2, сегодня измерены 29 линий этой серии), константу Rλ = 1,097×1071/м с тех пор называют «постоянной Ридберга». Что поразительно, формула (3), а значит и формула (2), даёт точность до 13 знаков после запятой.
Это открытие послужило толчком для обнаружения других серий в спектре атома водорода: серий Лаймана k = 1 (1904 г.), Пашена k = 3 (1909 г.) и др.
Мы обещали объяснить связь спектров с точностью, однако это будет значительно естественнее после рассказа о введении в теорию излучения кванта энергии Максом Планком. А до этого, предложим вдумчивому читателю качественно объяснить, как влияет на характер наблюдаемого спектра плотность исследуемого вещества.
Дальше, после раскрытия тайны «ультрафиолетовой катастрофы» и введения упомянутого выше кванта энергии, начинается настоящая история атома. Эта история завершилась теоретическим выводом формулы (3), но с привлечением совершенно новых не классических, а уже квантовых идей.
И выпала эта честь великому физику ХХ века, одному из творцов современной квантовой теории, Нильсу Бору.
А.М. Пальти, старший научный сотрудник по физике ВТСП


 Основатель и издатель
Основатель и издатель Copyright © 2016–2021 Научно-популярный
Copyright © 2016–2021 Научно-популярный