История сохранила имя древнего атомиста Мосха Сидонского из Сидона в Финикии (ныне г. Сайда в Ливане), который жил в ХII столетии до н. э. К тому же времени относятся взгляды китайского учёного Вен Ванга, полагавшего, что все вещества построены из наименьших частиц «ци».

древнегреческий философ-материалист.
Основатель античного
атомистического учения.
В индийской философии атомные представления развивал Кáнада (VI–V ст. до н. э.), который думал, что все материальные тела создаются из атомов земли, воды, воздуха и эфира.
Первые греческие философы-ионийцы Фалес, Анаксимандр, Анаксимен (VII–VI ст. до н.э.) создавали космологические модели, в которых делали попытки объяснить все явления, происходящие в мире, на основе определенной первоосновы.
Идеи атомизма прослеживаются также во взглядах Гераклита из Эфеса, Парменида Элейского, Эмпедокла из Акраганта на Сицилии, Анаксагора из Клазомен и других древнегреческих мыслителей.
Переход от этих философских размышлений к понятию атома сделали Левкипп из Милета и его ученик Демокрит из Абдеры.
Именно Левкипп считается основателем античной атомистики, которую потом развил Демокрит. Среди последователей атомистического учения следует также отметить Эпикура, который полагал, что за сложностью и бесконечным разнообразием мира, окружающего нас, прячется внутренняя простота, характерная для тех уровней энергии, которые недоступны нашему непосредственному восприятию.
После смерти Демокрита выдающийся греческий мыслитель Аристотель, ученик Платона, полагал, что процесс деления вещества может быть бесконечным. Такой подход на много столетий стал доминирующим, а учение Демокрита забыли почти на 2000 лет.
На протяжении последующих многих столетий не было высказано никаких новых идей о структуре материи. Научная мысль в этом направлении начала возрождаться только в ХVII столетии.

После долгого забытья атомистических идей французский философ и математик Пьер Гассенди (1592–1655) возвратился к идее атомизма. Он выступал против аристотелево-схоластической картины мира, которая доминировала в те времена, против Декарта и картезианства.
Физику он рассматривал на основе атомистики Демокрита, полагал, что все тела создаются как определенные комбинации атомов, наряду с которыми существует пустое пространство, в котором происходит движение тел.

изображен на купюре в 25 динаров,
Хорватия.
Бошкович сделал вклад в теорию
орбитальной механики и был одним
из первых, кто размышлял
о силах между атомами
Различные физические и химические явления на основе атомистического подхода объяснял хорватский ученый Руджер Йосип Бошкович (1711–1787). Его идеи существенно повлияли на дальнейшее развитие естественных наук и оказались полезными для формирования физических и химических теорий XX столетия.
Однако не следует думать, что древнегреческие мыслители и их последователи благодаря гениальной интуиции действительно установили атомную структуру материи. На протяжении многих столетий атомы были только умозрительными понятиями, так как не было никакой возможности проверить их существование.
Только создание устройств, позволивших экспериментально изучать свойства и структуру атомов, знаменовало новый научный этап в истории физики микромира.
Это была уже эпоха атомной физики, точнее, физики микрообъектов, в которой явления микромира описывались на основе разработанной физиками квантовой механики.
Дальнейшие исследования многих учёных XVIII–XIX столетий привели к тому, что во второй половине XIX века была подготовлена почва для развития экспериментальных исследований структуры атомов и молекул.
В 1910–1911 годах немецкий физик Ганс Гейгер и новозеландец Эрнест Марсден, работавшие в Кембридже под руководством англичанина Эрнеста Резерфорда (1871–1937), выполнили важные эксперименты по рассеянию альфа-частиц в тонких пленках.

изображен на Новозеландской
стодолларовой банкноте
Основываясь на результатах этих исследований, Резерфорд открыл атомное ядро (1911) и разработал планетарную модель атома (модель атома Резерфорда). Термин «ядро» он предложил в 1912 г.
В результате этих исследований также было установлено, что линейный размер ядра (радиус ядра) очень мал Rяд ~ 10-14 м, но в ядре содержится почти вся масса атома. Ядро обладает положительным электрическим зарядом, а его объём составляет приблизительно 10-12 объёма атома.
Однако революционное открытие атомного ядра и создание планетарной модели атома столкнулись с большими трудностями, так как электрон, движущийся по криволинейной траектории в электрическом поле ядра, в соответствии с классической электродинамикой должен излучать электромагнитные волны.
Вследствие этого его энергия будет уменьшаться, также будет быстро уменьшаться и радиус его траектории (орбиты), т.е. электрон очутится в центре атома, где расположено атомное ядро, что вызовет коллапс атома, и атом перестанет существовать. Между тем было известно, что стабильные атомы «живут» бесконечно долго.
Таким образом, стало понятно, что классическая физика оказалась неспособной объяснить структуру атома.
Важный шаг для объяснения структуры атома на основе полуклассических соображений сделал датский физик Нильс Бор (1885–1962), сформулировавший постулаты, позволившие понять структуру атома водорода.
Бор получил формулу для энергетических состояний атома водорода, воспользовавшись равенством центробежной и электрической сил, действующих на заряженную частицу (электрон), движущийся по круговой орбите в электрическом поле ядра (протона).
Кроме того, он предположил, что момент импульса электрона в атоме водорода может принимать только дискретные значения. Из этих предположений вытекало, что электрон в атоме водорода может находиться как угодно долго только в определенных стационарных состояниях, характеризующихся такими значениями его полной энергии:
|
|
(1) |

где m – масса электрона; e – абсолютная величина заряда электрона; ħ – постоянная Планка; n – главное квантовое число, которое может принимать значения n = 0; 1; 2; …; знак минус в формуле (1) означает, что между электроном и ядром атома (протоном) действует электрическая сила притяжения.
На рис. 1 приведен энергетический спектр атома водорода, рассчитанный с помощью формулы (1).
Из формулы (1) следует, что атом, находящийся в возбужденном состоянии с энергией En, может перейти в состояние с энергией Es, вследствие чего будет излучаться фотон с энергией
|
|
(2) |
где ωns – частота фотона.
Формула (2) представляет собой правило частот Бора. После подстановки в формулу (2) выражения для энергии (1) получаем:
|
|
(3) |
В формуле (3) число s определяет серию частот (при s = 1 имеем серию Лаймана, при s = 2 – серию Бальмера, при s = 3 – серию Пашена), а число n определяет линию в серии. Для каждой серии выполняется условие n > s.
Благодаря своей гениальной научной интуиции Бор нашёл правильную формулу для энергий электрона в атоме водорода (энергетический спектр атома водорода), но способ её получения не выдерживает серьёзной критики с точки зрения современной квантовой механики, разработанной позже, которая позволила получить эту формулу совсем иным методом на основе решения уравнения Шредингера.
Отметим, что задача об атоме водорода является ключевой для понимания структуры всех атомов.
В квантовой механике частица или система частиц характеризуется орбитальным моментом импульса l и собственным моментом импульса (спином) s, измеряемых в единицах постоянной Планка ħ.
Орбитальный момент связан с движением микрообъекта в пространстве и может принимать значения l = 0; 1; 2; … В отличие от орбитальных моментов спины микрообъектов могут быть как целыми, так и полуцелыми числами.
Смысл главного квантового числа n в модели Бора и в квантовой механике разный. В модели Бора это орбитальный момент l, тогда как в квантовой механике имеем n = nr+ l + 1, где nr представляет собой так называемое радиальное квантовое число.
Принципиальная разница между моделью Бора и квантовой механикой заключается в том, что энергия основного состояния атома водорода, равная согласно формуле (1) E1=-me4/(2ħ2), в модели Бора соответствует орбитальному моменту l = 1, тогда как в квантовой механике в этом случае имеем l = 0.
Дальнейшие экспериментальные исследования показали, что формула (1) в основном правильно описывает энергетический спектр атома водорода. Однако оказалось, что этот спектр имеет более сложную структуру, которую можно понять только на основе квантовой электродинамики.
Иными словами, энергетический спектр атома водорода имеет тонкую и сверхтонкую структуры, для объяснения которых нужно воспользоваться релятивистской квантовой механикой и учесть наличие собственных моментов импульсов (спинов) электрона и протона (ядра атома водорода).
В квантовой механике состояния электрона в атоме водорода с определенными значениями орбитального момента l обозначаются латинскими буквами согласно схеме:
| l | 0 | 1 | 2 | 3 | 4 | 5 | 6 | … | (4) |
| s | p | d | f | g | h | i | … |
Для обозначения состояния электрона с определенными значениями n и l используется число для n и буква для l. Например, состояние с n = 1, l = 0 обозначается 1s; состояние с n = 2, l = 1 – 2p и т. д.
Орбитальный момент и спин складываются в полный момент импульса j. Так как спин электрона равен s = ½, то полный момент импульса электрона составляет j = l ± ½ для l ≠ 0 и j = ½ для l = 0. Полный момент импульса может принимать значения в интервале |l – ½| ≤ j ≤ l + ½.
Состояние электрона в атоме водорода с определенными значениями n, l, j обзначается так: 1s½ для n = 1, l = 0, j = ½; 2p½ для n = 2, l = 1, j = ½; 2p3/2 для n = 2, l = 2, j = 3/2 и т. д. Подчеркнём, что моменты импульсов в квантовой механике измеряются в единицах постоянной Планка ħ.
Для определения тонкой структуры уровней энергии атома водорода нужно использовать релятивистское уравнение Дирака, приближённое решение которого с точностью до членов порядка (v/c)2 зависит от главного квантового числа n и полного момента импульса электрона j:
|
|
(5) |
где энергия En определяется формулой (1), величина α = e2/(ħc) ≈ 1/137 называется постоянной тонкой структуры.
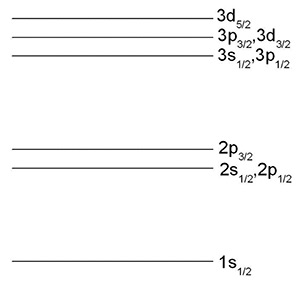
Из формулы (5) следует, что расщепление уровней атома водорода (тонкая структура), обусловленная релятивистскими эффектами, пропорциональна квадрату постоянной тонкой структуры, являющейся малой величиной.
Однако в таком подходе состояния электрона с l = j ± ½ при заданных величинах n, j имеют одинаковые энергии. Например, пары уровней (2s1/2, 2p1/2), (3s1/2, 3p1/2), (3p3/2, 3d3/2) и т. д. имеют одинаковые энергии.
На рис. 2 приведена схема уровней атома водорода с учётом тонкой структуры.
Американские физики Уиллис Юджин Лэмб (1913–2008) и Роберт Ризерфорд (1912–1981) в 1947 г. провели экспериментальное исследование уровней 2s1/2 и 2p1/2 атома водорода с помощью радиоспектроскопического метода.
Они выяснили, что энергия уровня 2s1/2 превышает энергию уровня 2p1/2 на величину
|
ωэксп = (1057,90 ± 0,06) МГц, |
(6) |
где частота связана с энергией соотношением E = ħω.
Этот эффект получил название лэмбовского сдвига уровней энергии атома водорода. Таким образом, выяснилось, что энергетический спектр атома водорода имеет более сложную структуру, чем это вытекает из уравнения Дирака (рис. 3).
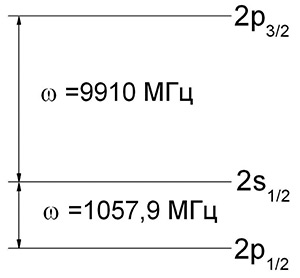
Первое объяснение лэмбовского сдвига на основе полуклассических соображений дал Ганс Бете (1906–2005) в 1947 г. Он установил, что соответствующая поправка к энергии по порядку величины составляет ΔE~α5ln(1/α). Позже этот эффект был объяснен на основе квантовой электродинамики.
Объяснение лэмбовского сдвига методами квантовой электродинамики основывается на учёте взаимодействия электрона с вакуумом электромагнитного поля, при котором происходит излучение и поглощение электроном виртуальных фотонов.
Фотоны представляют собой частицы (кванты) электромагнитного поля, т. е. считается, что электромагнитное поле одновременно имеет корпускулярную и волновую природу.
Иными словами, можно утверждать, что электромагнитному полю присущ корпускулярно-волновой дуализм. Сосуществование корпускулярных и волновых свойств в одном физическом объекте характерно для квантовой физики.
Поправки к энергии, обусловленные рассмотренными выше эффектами, называются радиационными поправками. При проведении таких расчётов выяснилось, что для достижения полного совпадения теоретических результатов с экспериментальными данными нужно было уточнить величину магнитного момента электрона μe.
Оказалось, что взаимодействие электрона с вакуумом электромагнитного поля приводит к увеличению магнитного момента электрона по сравнению с магнетоном Бора.
Такая поправка к μe называется аномальным магнитным моментом электрона. Она определяется формулой:
|
|
(7) |
Окончательно теоретическая оценка лэмбовского сдвига составляет:
|
ωтеор = 1057,911 МГц. |
(8) |
Последняя величина хорошо согласуется с экспериментально измеренной (6).
Исследование лэмбовского сдвига стало важным толчком для дальнейшего развития квантовой электродинамики. Подчеркнём, что учёт радиационных поправок и аномального магнитного момента электрона приводит к тому, что уровни с одинаковыми величинами моментов импульсов n и j, но с разными значениями l = j ± ½, имеют разные энергии, что согласуется с экспериментальными данными (рис. 2).
Рассмотрим теперь сверхтонкую структуру уровней энергии атома водорода, обусловленную взаимодействием магнитных моментов атомного электрона и ядра атома (протона).
Спин протона равен s = ½, а его магнитный момент составляет μp = 2,79 μN, где величина μN называется ядерным магнетоном, mp – масса протона. В релятивистской квантовой теории можно убедиться, что сверхтонкое расщепление испытывают только s-состояния. Частота излучения при переходе между компонентами основного 1s½ состояния атома водорода равна:
|
|
(9) |
Экспериментальное значение этой величины составляет:
|
Δωексп = (1420,405751768 ± 0,002) МГц. |
(10) |
Учёт релятивистских поправок, конечности массы ядра и аномального магнитного момента электрона приводит к согласию результата теоретического расчета с экспериментально измеренной величиной (10).
Частоте (10) соответствует длина волны
|
|
(11) |
Это означает, что водород во Вселенной можно определять по излучению с длиной волны 0,21 м.
Такое явление важно в астрофизике, так как наибольшее количество вещества во Вселенной составляет водород, являющийся хорошим «радиопередатчиком» на волне 0,21 м.
Рассмотренное излучение было открыто в 1951 г. и с тех пор изучается для определения распределения и движения межзвездного газа в нашей и других галактиках с помощью радиотелескопов, настроенных на «водородную волну».
Наблюдение излучения с длиной волны 0,21 м позволило выяснить распределение плотности водорода в Галактике, а также скорость вращения Галактики.
Тонкое и сверхтонкое расщепление энергетических уровней наблюдается также у многих сложных атомов, спины ядер которых отличны от нуля. Экспериментальное исследование сверхтонкого расщепления атомных уровней энергии является одним из методов измерения спинов и магнитных моментов атомных ядер.
Это явление используется также для определения эталона единицы времени. Так, секунда – это промежуток времени, равный 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия 133Cs.
Сейчас происходит стремительное развитие нано технологий. Эта область науки и техники требует от специалистов глубокого понимания структуры атомов и молекул.
Автор надеется заинтересовать молодёжь этими проблемами для дальнейшего изучения этого важного направления современной науки.
Ю.А. Бережной, доктор физ.-мат. наук, заслуженный рофессор Харьковского национального университета им. В. Н. Каразина, лауреат премий НАН Украины им. А. С. Давыдова и К. Д. Синельникова




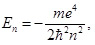
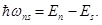
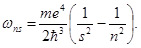
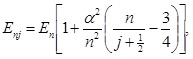
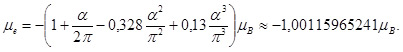
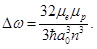
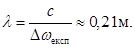






 Основатель и издатель
Основатель и издатель Copyright © 2016–2021 Научно-популярный
Copyright © 2016–2021 Научно-популярный