
Нобелевская премия по физиологии и медицине 2018 года
If I have seen, further it is by standing upon the shoulders of Giants.
Исаак Ньютон
Если я смог видеть вдаль, так это потому, что стоял на плечах Гигантов
Награждение Лауреатов Нобелевской премии по физиологии и медицине 2018 года стало чрезвычайным и резонансным событием не только в научном мире, но и среди широких слоёв населения планеты. Это не просто громкие слова, это реалии нашей жизни, за которой по пятам следует чума ХХ века – онкологические заболевания, а победители в номинации «Физиология и медицина», Джеймс Эллисон и Тасуку Хондзё, предложили новый способ лечения смертельной болезни и подарили миру надежду на победу в борьбе с ней.

- иммунолог, специалист по иммунотерапии
рака, профессор Онкологического центра
им. Андерсона Техасского университета (США).
Лауреат Нобелевской премии по физиологии
и медицине 2018 совместно с Т. Хондзё
1 октября 2018 в 11.30 по Гринвичу весь мир услышал имена новых нобелиантов и суть предложенного ими терапевтического метода, и с той минуты обсуждения и дискуссии не утихают. Мы тоже решили присоединиться к разговору на эту тему, заглянуть под покров научной тайны и проанализировать, какие открытия сделали возможным новый прорыв в медицине.
Нобелевский комитет сформулировал своё решение о присуждении премии Дж. Эллисону, специалисту по иммунотерапии рака, профессору Онкологического центра им. Андерсона Техасского университета (США), и Т. Хондзё, иммунологу из Киотского университета (Япония), следующим образом: «За открытие терапии рака путём ингибирования отрицательной иммунной регуляции».
Для понимания сути такой терапии необходимо объяснить принцип формирования иммунного ответа организма.
Для защиты от опасного воздействия чужеродных объектов (микробы, вирусы, опухоли, микроскопические грибы) наш организм вооружён мощной защитной системой – иммунитетом (с лат. immunitas – освобождённый, избавлен от чего-либо), в арсенале которого есть специальные клетки (Т-киллеры или цитотоксические Т-лимфоциты), которые способны убивать и уничтожать клетки-пришельцы.

из Киотского университета (Япония).
Лауреат Нобелевской премии по физиологии
и медицине 2018 совместно с Дж. Эллисоном.
Т-киллеры движутся по лимфе и крови, так сказать, патрулируют организм с целью выявления угрозы здоровью. В случае появления противника, «чужого», Т-киллеры вступают с ним в непосредственный контакт и уничтожают. Для полного избавления от опасности организм вырабатывает необходимое для этого количество цитотоксических Т-клеток.
Но, чтобы не нарушить границу необходимости, и клетки-убийцы неожиданно не начали атаковать здоровые органы и ткани собственного организма (так запускаются аутоиммунные заболевания), в иммунной системе существуют тормоза, механизм уменьшения (до полного прекращения) защитного действия, а именно, приостановление образования новых Т-киллеров и инактивация уже существующих. Для этого на поверхности цитотоксических Т-лимфоцитов находятся два участка, включение которых как раз и тормозит иммунный ответ.
По этой причине такие участки были названы контрольными иммунными точками. Сбой в работе данного механизма проявляется, в частности, в аутоиммунных заболеваниях (ревматоидный артрит, рассеянный склероз, лимфатичий лейкоз, витилиго и другие), и учёные давно находились в поисках путей налаживания отрицательной регуляции иммунного ответа.
Но по отношению к злокачественной опухоли иммунная система ведёт себя довольно странно, а именно, не проявляет к ней агрессивного воздействия, считая «своими» опухолевые клетки. Почему так происходит?
Выяснилось, что опухолевые клетки содержат специальные «ключи» (молекулы небольших размеров) для включения контрольных иммунных точек на поверхности Т-киллеров, что приводит к их инактивации.
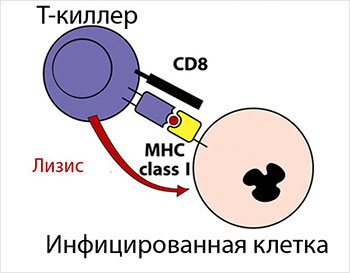
иммунных клеток, которые производятся
в тимусе (вилочковой железе) и циркулируют
в крови. Они проявляют токсическое действие
по отношению к чужеродным клеток путем
непосредственного контакта с последними
и вызывают их разрыв (лизис).
Данный механизм удалось выяснить одному из Нобелевских лауреатов этого года японскому иммунологу Тасуку Хонндзё. Другому Нобелевскому лауреату, Джеймсу Эллисону, принадлежит идея о необходимости блокировки тормозов иммунной системы для подавления онкологического роста.
«Я понял, – говорит Дж. Эллисон, – в случае опухоли надо не давить на тормоза, а отпустить их!». В качестве блокаторов контрольных иммунных точек Джеймс Эллисон использовал моноклональные антитела.
Вот так выглядит суть предложенного нового подхода для лечения онкологических заболеваний.
Но открытие, получившее высокую награду научного сообщества в этом году, – это лишь верхушка айсберга, 9 из 10 частей которого остаются невидимыми для широкой общественности, но именно они сделали возможным сегодняшний мощный шаг вперёд на пути к победе над онкологическими заболеваниями.
Было бы несправедливым не вспомнить все события биологической науки, ставшие фундаментом этой Нобелевской истории.
Открытие Дж. Эллисона и Т. Хондзё относится к области имуноонкологии, соединившей два отдельных направления биологии и медицины, иммунологию и онкологию. Каждая из них формировалась и развивалась независимо друг от друга, но на определённом этапе их пути пересеклись и слились в один.
Нам бы хотелось проследить, когда и как это произошло, а также вспомнить участников тих событий, выдающихся учёных, усилия которых повлияли на развитие иммунологии и онкологии, стали частью фундаментальных знаний и были отмечены в разные годы Нобелевской премией по физиологии и медицине.
О существовании в организме человека особых, похожих на амёб, подвижных клеток, которые способны захватывать и переваривать патогенные микроорганизмы, предположил, а затем и доказал это в начале 80-х годов XIX века выдающийся российский иммунолог Илья Ильич Мечников (1845–1916). В 1883 году на съезде врачей-естествоиспытателей в Одессе он сделал доклад на эту тему.
Свои наблюдения он сформулировал как фагоцитарную теорию иммунитета (фагоцитоз – с дав.-греч. Φαγεῖν «пожирать» + κύτος «клетка», «оз» – окончание для обозначения текущего процесса).
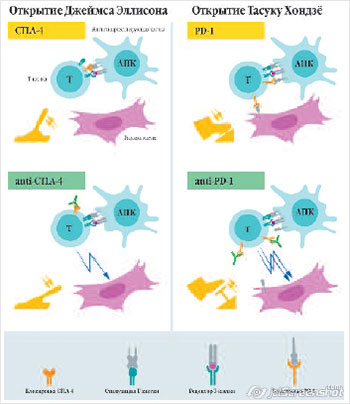
отрицательной иммунной регуляции.
На поверхности Т-клеток находятся участки
(встроенные в плазматическую мембрану
молекулярные белковые комплексы
рецепторной природы) CTLA-4 и PD-1,
связывание с которыми
соответствующих участков антиген
презентирующих клеток (АПК) прекращает
иммунный ответ организма, то есть
останавливает цитотоксическое действие
Т-киллеров по отношению к клеткам-мишеням.
Открытие Тасуку Хондзё заключается в
идентификации PD-1 и наличии в
опухолевых клетках молекул (PDL-1),
которые связываются с PD-1,
и тем самым инактивируют Т-киллеры.
Открытие Джеймса Эллисона заключается
в идентификации CTLA-4 и необходимости их
блокирования моноклональными антителами
для повышения противоопухолевого
иммунитета.
Параллельно сформировалась другая теория иммунитета, в основе которой лежит защитная функция крови. Первым, кто наблюдал и доказал образования антитоксинов (соединений, связывающих и нейтрализующих ядовитые молекулы – токсины) в крови людей, переболевших дифтерией или столбняком, был немецкий врач Эмиль фон Беринг (1854–1917) в 1890 году. Он показал, что именно эти соединения обеспечивают иммунитет к болезни, как у переболевших ею, так и у тех, кому была перелита кровь первых. Э. фон Беринг стал первым, кто использовал антитоксины крови для лечения инфекционной болезни.
В следующем, 1891 году, другой немецкий врач-иммунолог и фармаколог Пауль Эрлих (1854–1915) ввёл термин «антитело», которым назвал эти противомикробные вещества крови, анитоксины Э. фон Беринга, и заложил основы гуморальной теории иммунитета (от лат. humor – жидкость).
П. Эрлих заметил, что антитела отличаются высокой специфичностью (производятся организмом для связывания с одним конкретным токсическим по отношению к организму протеином) и находятся на поверхности клеток в виде участков связывания – рецепторов. Две теории иммунитета развивались и разрабатывались независимо друг от друга и в период накопления новых знаний в этой области находились на антагонистических позициях.
Начало ХХ века стало точкой отсчёта в истории присуждения Нобелевской премии за выдающиеся заслуги в пяти областях науки и общественной деятельности. Первым её лауреатом в номинации «Физиология или медицина» в 1901 году стал именно Эмиль фон Беринг «за работу по сывороточной терапии, главным образом за её применение при лечении дифтерии, что открыло новые пути в медицинской науке и дало в руки врачей победоносное оружие против болезни и смерти ». Это событие можно считать весьма символичным как признание важного этапа в развитии иммунологической биологии.
Вскоре выяснилось, что клеточный и гуморальный иммунитет являются звеньями единой защитной системы организма. Поэтому в 1908 году Нобелевский комитет принял решение разделить ежегодную премию по физиологии и медицине между авторами двух теорий иммунитета, И.И. Мечниковым и П. Эрлихом.
1911 год вошёл в историю науки ярким открытием в области онкологии. Американский патологоанатом Фрэнсис Пейтон Роус (1879–1970) выяснил, что злокачественную опухоль (в частности, саркому) домашней курицы, можно перенести на другую домашнюю птицу, для этого достаточно ввести здоровым птицам безклеточный фильтрат опухолевой ткани.
Учёный сделал вывод, что рак может быть передан вирусом (теперь известным как вирус саркомы Роуса, ретровирус). А поскольку вторжение в организм вируса, в данном случае онковируса, вызывает иммунный ответ, то экспериментальные достижения американского учёного-патолога можно считать первым шагом на пути объединения иммунологии и онкологии.
Это сегодня, с высоты времени, мы считаем те события ключевыми в развитии науки, а тогда за свои наблюдения Ф. Роус подвёргся серьёзной критике большинства экспертов. Прошло несколько лет, прежде чем кто-либо даже попытался воспроизвести его прогностические результаты.
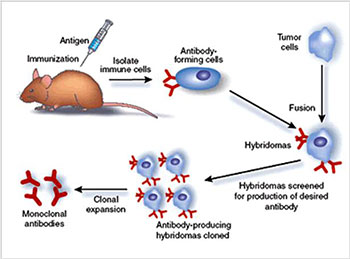
Животных (мышей) инфицируют определенным
антигеном. В их крови появляются
В-лимфоциты, которые начинают вырабатывать
антитела к этому антигену. В-лимфоциты
мыши выделяют из их крови, сливают с
гистогенетически близкой опухолью
(миеломой), после чего вновь вводят
животному в кровь.
После этого гибридные В-лимфоциты
(гибридомы) начинают продуцировать
специфическое антитело, которое получило
название моноклонального.
На определенном этапе, когда антител
образуется достаточно, кровь отбирают и
выделяют из неё антитела,
продуцируемые гибрдомами.
В следующем, 1912 году, уже на Европейском континенте также был сделан смелый шаг в исследовании онкозаболевания. Датский микробиолог и патологоанатом Йоханес Фибигер (1867–1928) вызвал у лабораторных крыс опухоль желудка после скармливания им тараканов, зараженных личинками Spiroptera carcinoma. Это была первая экспериментальная онкологическая модель, а её автор считается основателем экспериментальной онкологии.
За свои открытия Ф. Роус и И. Фибигер были внесены в список номинантов на Нобелевскую премию по физиологии и медицине в 1926 году, но победителем того года стал Йоханнес Фибигер.
Одну из первых попыток в поисках лечения онкологии сделал американский врач Чарльз Брентон Хаггинс (1910–1997). В 1941 году он вместе со своим коллегой Кларенсом Ходжесом обнаружил эффект подавления метастатического рака предстательной железы гормонами эстрогенами.
Только 25 лет спустя, когда была доказана эффективность нового способа борьбы с раком, в 1966 году Ч. Хаггинс получил половину Нобелевской премии по физиологии и медицине. Вторая половин «за открытие онкогенных вирусов» была присуждена его соотечественнику, о котором мы рассказали выше, – Фрэнсису Пейтону Роус. Во-первых, это было признание заслуг выдающегося врача-учёного, а, во-вторых, если весомость вклада в науку оказалась проверенной практикой и временем, то награда обязательно найдёт своего героя!
Иногда так случается, что прогресс некоторых научных направлений и выяснения причин возникающих на их пути, позволяет сделать открытие в других, на первый взгляд, не связанных с ними отраслях. Так, поиск решений для преодоления неудач трансплантологии в своё время дали новые знания о работе иммунной системы.
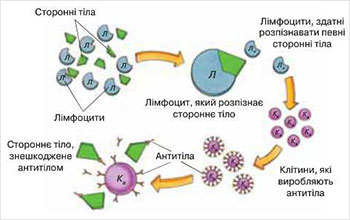
в организме. Антитела к чужеродным протеинам
(антигенам), которые содержатся в бактериях,
вирусах и опухолевых клетках,
вырабатывают функциональный тип
лимфоцитов - В-лимфоциты. Антитело
связывается с антигеном и прекращает его
действие. К каждому антигену существует
свое единственное антитело.
Связь антиген-антитело является
высокоспецифичным
Хирурги во время проведения операций по пересадке тканей и органов столкнулись с тем, что органы донора не всегда подходят для пересадки реципиентам, то есть организм последних не воспринимает, отторгает чужую ткань. Свет на понимание этой проблемы был пролит в конце 1960-х годов.
Независимые группы учёных-иммунологов в США (две лаборатории под руководством Баруха Банасерраф ( 1920–2011) и Джорджа Снелла (1903–1996)) и Франции (Жан Доссе (1916–2009) с коллегами) открыли принцип гистосовместимости (от греч. Ἱστός «ткань»), согласно которому на поверхности клеток организма присутствуют молекулярные комплексы (главный комплекс гистосовместимости, ГКГ), отвечающие за распознавание «свой-чужой» и задействованные в формировании иммунного ответа.
То есть, на поверхности клеток реципиента существуют такие молекулярные соединения, которые имеют участки для связывания с антигеном («antigen - antibody generation» (англ.), то, что генерирует антитела), и, если клетки донора несут такой антиген, то в организме реципиента запускается иммунный ответ – начинается синтез антител, которые вызывают отторжение донорского органа.
«За открытия, касающиеся генетически определённых структур на клеточной поверхности, регулирующих иммунные реакции» все трое учёных-иммунологов получили Нобелевскую премию по физиологии и медицине в 1980 году.
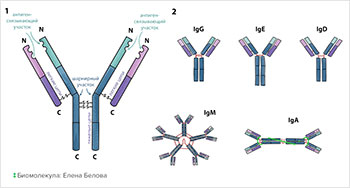
1. Схема строения антитела. Две тяжелые цепи
находятся внутри молекулы,
две легкие — снаружи. Все они сшиты друг
с другом дисульфидными мостиками (S-S).
2. Изотипы антител. Они определяются типом
константной части. Некоторые изотипы могут
образовывать димеры (IgA) и пентамеры (IgM)
с помощью соединительной цепи
(joining chain).
В 1974 году швейцарский иммунолог Рольф М. Цинкернагель (род. в 1944 г.) и его австралийский коллега Питер Ч. Догерти (род. в 1940 г.) обнаружили, что главный комплекс гистосовместимости функционирует не только как система распознавания своей и чужой ткани, но и как распознавание клетками иммунной системы (Т-киллерами) антигенов, являющихся протеиновыми фрагментами патогенных микроорганизмов и инфицированных клеток.
По заключению этих исследователей Т-киллер распознает мишень (антиген) только в единственном случае, когда этот антиген соединён с молекулой главного комплекса гистосовместимости, встроенной в мембрану фагоцитов, клеток популяции лейкоцитов, которые были описаны в своё время И.И. Мечниковым как клетки, способные захватывать и переваривать одноклеточные микроорганизмы – возбудители инфекций и болезней. А эти фагоциты, несущие на свой поверхности (презентирующие) антиген получили название антиген презентирующих клеток (АПК).
«За открытия в области иммунной системы человека, в частности его способности выявлять клетки, пораженные вирусом» Р.М. Цинкернагель и П.Ч. Догерти стали Лауреатами Нобелевской премии по физиологии и медицине в 1996 году.
Как было сформулировано ещё П. Ерлихом, организм вырабатывает антитела как молекулы защиты от инфекций и болезней, а главным свойством антител является их исключительная специфичность. То есть антитело вырабатывается для связывания только с одним конкретным антигеном, который становится при этом полностью безопасным.
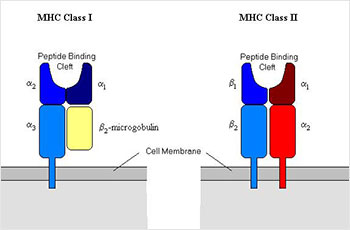
гистосовместимости I и II типа.
Мембранновстроенный белок, отвечаюший
за гистосовместимость,
то есть распознавание «свой-чужой»
Более того, выдающийся немецкий иммунолог утверждал, если возможно выработать антитела, то следовательно можно выделить и соответствующий токсин (антиген) в комплексе с этим антителом. Позже исследователи выяснили, что антитела вырабатываются определённым типом иммунных клеток – В-лимфоцитами.
Против каждого антигена вырабатываются антитела В-лимфоцитами одного клеточного клона, то есть образовавшимися из одной клетки-предшественника, которая несёт информацию о конкретном антигене. Учитывая такие свойства, антитела можно применять не только для лечения (как это делал в своё время Э. фон Беринг), но и диагностики. Для этого нужно было бы иметь возможность получать (нарабатывать) эти соединения, но сначала не мешало бы изучить их структуру.
Антитела представляют собой белки глобулиновой фракции сыворотки крови, а поскольку они производятся в организме в процессе формирования иммунного ответа, то получили название иммуноглобулинов. Несмотря на большое количество, тем не менее все антитела имеют сходное строение и делятся на несколько основных классов в зависимости от молекулярной массы (G, А, М, D, E, Y).
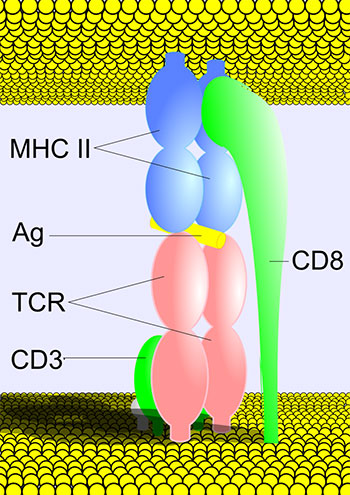
TCR – Т-клеточный рецептор
MHC II – главный комплекс гистосовместимости
II класса (класс комплекса, связывающегося
с рецепторами Т-киллеров)
Ag - антиген
CD3 – рецептор стабилизации TCR на поверхности
Т-клетки
CD8 – сорецептор Т-киллерных клеток
В течение 1960-х годов двум биохимикам – американцу Джеральду Морису Эдельману (1929–2014) и англичанину Родни Портера (1917–1985) удалось изучить и расшифровать молекулярную структуру антител.
В то время ещё не было метода очистки (выделения) этих соединений, поэтому Дж. Эдельман выдвинул идею изучения их структуры методом расщепления, то есть необходимо сначала принудительно расщепить молекулу, а затем изучать состав и строение её отдельных фрагментов, а Р. Портер разработал саму методику расщепления антител растительным ферментом папаином.
Вдвоём им удалось расшифровать строение иммуноглобулинов класса G (IgG). В течение 1965–1969 годов Дж. Эдельман распознал полную аминокислотную последовательность IgG миеломы – злокачественного заболевания костного мозга, что также стало вкладом в объединение иммунологии и онкологии.
Специфичность антител предусматривает их чрезвычайное многообразие. Но какой именно механизм в организме реализует её? Дж. Эдельман выдвинул теорию, что в основе разнообразия антител лежат ошибки в рекомбинации генов (перераспределение, перестановка генов после разрывов цепи молекул ДНК), но в то время не было соответствующих методик для проверки новой теории.
Тандем Дж. Эдельмана и Р. Портера «за свои открытия, касающиеся строения антител» в 1972 году получили Нобелевскую премию по физиологии и медицине.
После расшифровки иммуноглобулина миеломы, в 1970-е годы, была создана экспериментальная модель опухолевых B-лимфоцитов (клеток миеломы), которые синтезировали один и тот же тип антител (парапротеин – белок с аномальными структурой и функцией).
Эти клеточные культуры использовались для продолжения изучения строения молекулы антитела, но не было методики, которая позволяла бы производить идентичное антитело к заданному антигену – моноклональное антитело (МАТ).
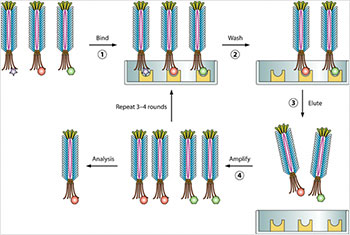
Метод, в котором специфическая
последовательность белка искусственно
вводится в ген белка оболочки бактериофага,
вызывая экспрессию белка
на внешней стороне бактериофага.
Такую методику создали в 1975 году немецкий иммунолог Георг Кёлер (1946–1995) и его британский коллега Сезар Мильштейн (1927–2002). Их идея заключалась в том, чтобы взять линию миеломных клеток, которые потеряли способность синтезировать свои собственные антитела, и слить такую клетку с нормальным B-лимфоцитом, не утратившим такой способности. После слияния отобрать образованные гибридные клетки, которые синтезируют нужное антитело. Этот замысел был успешно реализован.
После усовершенствования процесса наработки и очистки моноклональных антител с 1980 года начинается их коммерческое производство, которое открыло новые перспективы терапии с использованием антител для лечения тяжёлых заболеваний, в частности аутоиммунных. Но надо заметить, что эта технология является чрезвычайно сложной и требует применения дорогих материалов, реактивов и оборудования, а значит препараты на их основе чрезвычайно дорогие.
«За теории относительно специфичности в развитии и контроле иммунной системы и открытие принципа продукции моноклональных антител» Г. Кёлер и С. Мильштейн в 1984 году были награждены Нобелевской премией по физиологии и медицине.
На вопрос о механизмах реализации разнообразия антител, (теорию о таком разнообразии сформулировал Дж. Эдельман), нашёл ответ японский молекулярный биолог Тонегава Сусуму (род. 1939). В 1976 году он начал серию экспериментов на мышах, в которой сравнивал ДНК B-лимфоцитов из мышиных эмбрионов и из взрослых мышей.
антител (метод Винтера)
Оказалось, что гены в B-лимфоцитах взрослого животного перемещаются, рекомбинируют и вырезаются, что приводит к огромному количеству вариабельных участков антител (участок, который специфически распознаёт и связывает чужеродный протеин, антиген). Такое разнообразие даёт иммунной системе возможность найти необходимый вариант антитела, который будет связывать антиген, и начать его синтез в количествах, необходимых для подавления инфекции, попавшей в организм.
В 1987 году «за открытие генетического принципа образования разнообразия антител» Тонегава получил Нобелевскую премию по физиологии и медицине.
В конце 1970-х годов произошло, на наш взгляд, окончательное формирование иммуноонкологии как отдельного комплексного направления биологической и медицинской наук. Джон Бишоп и Харолд Вармус из Университета Калифорнии (Сан-Франциско, США) исследовали, как вирус саркомы Роуса (и опять знакомый нам Фрэнсис Роус, основоположник этого направления) трансформирует инфицированные клетки в опухолевые.
В это время Хауард Темин и Дэвид Балтимор открыли обратную транскриптазу (за что получили Нобелевскую премию по физиологии и медицине в 1975 году), ключевой фермент ретровируса. Дж. Бишоп смог описать механизм копирования РНК с ДНК обратной транскиптазой и охарактеризовал вирусную РНК инфицированной клетки. Дж. Бишоп и Г. Вармус идентифицировали клеточный ген (c-src).
Они обнаружили, что c-src появился в вирусном геноме в результате захвата нормального клеточного гена (протоонкогена – гена, кодирующего белки клеточного роста и дифференциации, который при определённых условиях может мутировать в онкоген) в процессе трансдукции (передачи генетической информации). Мутация этого гена превратила его в онкоген (v-src).
Это открытие позволило медицине активно развиваться в направлении укрепления иммунитета против широкого спектра заболеваний, в частности рака, а также снижение эффекта аутоиммунных реакций организма.

- американский химик, профессор биологии
Университета Миссури-Колумбия, известный
исследователь фаговых дисплеев и автор
одноименного метода. Лауреат Нобелевской
премии по химии 2018
(1/2 премии совместно с Г. Винтером)
В 1989 году Дж. Бишоп и Х. Вармус были удостоены Нобелевской премией по физиологии и медицине «за открытия клеточной природы ретровирусных онкогенов».
Благодаря коммерческому производству и выделению различных гибридов антител против определённых антигенов был клонирован ген интерлейкина II, важного регулятора Т-клеток. Это дало возможность понять и описать молекулярные механизмы активации этих иммунных клеток благодаря следующим открытиям:
- в 1984 году был идентифицирован главный Т-клеточный рецептор (TCR), который является особым участком на поверхности Т-лимфоцитов для их непосредственного контакта с антигеном. Канадский иммунолог Так Ва Мак (Университет Торонто), который изучал необходимые для проведения таких исследований методы генной инженерии в лаборатории под руководством Нобелевского лауреата Хауарда М. Темина, обнаружил этот рецептор на человеческих Т-клетках, а его британский коллега Марк М. Дэвис (Стэнфордский Институт иммунологии, Великобритания ) – на мышиных. Эти исследования показали сущность, функции и структуру главного Т-клеточного рецептора, который за свою неуловимость до этого момента называли «святым Граалем иммунологии»;
- в 1988 году обнаружен ещё один рецептор на Т-клетках - CD28, также мембранно встроенный белковый комплекс на поверхности Т-лимфоцитов. Применение моноклональных антител против этих рецепторов полностью ингибировало активацию иммунных клеток, что доказывало функцию CD28 как дополнительного рецептора (корецептор), через который передаётся сопутствующий сигнал активации (костимуляции);
- в 1995 году произошла идентификация рецептора CD80 (86) на мембране антигенпрезентирующих клеток (АПК). Именно с этим рецептором должен связываться рецептор CD28 Т-клеток, и этот комплекс обеспечивает полную активацию этих иммунных клеток.
Но вернёмся к моноклональным антителам. В начале 1980-х годов коммерческое производство мышиных МАТ приобрело широкий масштаб, но их применение для диагностики и лечения людей было ограничено, поскольку введение таких моноклональных антител человеку вызвало иммунную реакцию отторжения. Необходимо было создать метод получения человеческих антител.
И первым шагом на этом пути стала разработка в 1985 году американским биологом и химиком Джорджем Смитом из университета Дьюка (штат Северная Каролина) элегантного метода, известного как «фаговый дисплей».
Благодаря этому методу бактериофаг, вирус, который заражает бактерии, можно использовать для получения новых белков. Суть метода заключается в том, что специфическая последовательность нуклетоидов определённого белка искусственно вводится в ген белка оболочки бактериофага, и это приводит к экспрессии белка на поверхности вируса.

- британский биохимик и биотехнолог,
специалист по белковой инженерии,
профессор Кембриджского университета,
член Лондонского королевского общества
и Академии медицинских наук Великобритании.
Разработал метод гуманизации мышиных
моноклональных антител с использованием
способа фагового дисплея. Лауреат Нобелевской
премии по химии 2018
(1/2 премии совместно с Дж. Смитом)
Идея создания метода пришла Дж. Смиту, когда он провёл слияние гена нужного ему пептида с геном III (ответственным за синтез белков мембраны) нитчатого фага и затем обнаружил интересовавший его пептид на внешней поверхности мембраны этого фага.
Для осуществления подобных манипуляций специалист должен обладать ювелирными методами генной инженерии, позволяющими вмешиваться в структуру генома и вносить определённые изменения. Этими методами Джордж Смит овладел за 10 лет до своего изобретения во время постдокторской стажировки в университете Висконсина под руководством Оливера Смитис (1925–2017), известного генетика, автора принципа создания специфических генных модификаций у мышей с использованием эмбриональных стволовых клеток (метода нокаута генов, метода исключения из ДНК определённого участка, который отвечает за синтез соответствующего белка). За что он в 2007 году получил Нобелевскую премию.
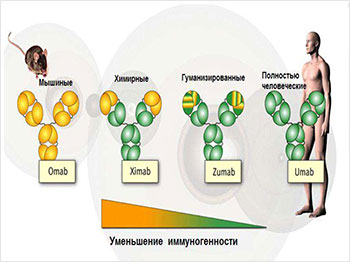
Уже в следующем после открытия Дж. Смита году, 1986-м, британский биохимик и фармаколог, специалист Кембриджского университета Грегори Пол Винтер разработал наконец методику гуманизации мышиных моноклональных антител.
Идея заключалась в том, чтобы заменить определённую протеиновую часть молекулы иммуноглобулина (антитела) мышей на соответствующий белковый компонент человеческого антитела. Такие антитела получили название химерных.
Дальнейшая направленная эволюция химерных антител, которую стало возможным реализовать благодаря разработанному Дж. Смитом методу фагового дисплея, в конце концов приведёт к получению полностью человеческого антитела.
Использование созданной технологии позволило Г. Винтеру в 1989 году организовать при Кембриджском университете производство первых лечебных препаратов на основе МАТ, которые стали коммерчески успешными и выпускаются до сих пор. Среди них: Campath-1 (аlemtuzumab), он показан для лечения лимфатического лейкоза, Т-клеточной лимфомы и рассеянного склероза, и HUMIRA (adalimumab, анти-TNFα), среди показаний к применению которого: ревматоидный артрит, псориаз, язвенный колит, болезнь Крона.
К середине 1980-х годов почти полностью был раскрыт механизм реализации иммунного ответа, но вопрос её негативной регуляции, то есть торможение этих процессов как одной из причин развития аутоиммунных заболеваний, оставался открытым.
Пионерами исследований этого направления иммунологии стала группа учёных под руководством Пьера Гольштейна из Иммунологического центра Марселя-Лумина (Марсель, Франция). В 1987 году в журнале «Nature» они публикуют статью о том, что идентифицирован новый белок семьи иммуноглобулинов, который является мембраносвязанным и экспрессируется на поверхности активированных Т-клеток после индукции их цитотоксичности.
Белок был назван CTLA-4 (cytotoxic lymphocytes antigen 4), и стало понятно его участие в инициации процессов торможения иммунного ответа.
Вскоре, уже в начале 1990-х годов, был найден ещё один протеин с подобной функцией. Его идентификация – заслуга одного из нынешних Нобелевских лауреатов, японского специалиста по иммунологии Киотского Университета Тасуку Хондзё.
В то время наблюдался большой интерес биохимиков к изучению процесса запрограммированной клеточной гибели (programmed cell death), который с 1972 года получил название апоптоз. Такой интерес был обусловлен тем, что гибель клетки этим путём является безболезненной для организма, так как не приводит к инициации воспалительных процессов как причины патогенеза.

по физиологии и медицине
Т. Хондзё с коллегами занимался изучением генетических факторов апоптоза на тимоцитах – клетках главного иммунного органа – тимуса. Японские учёные провели скрининг (пересмотр имеющихся в наличии генов с целью выявления искомого) погибающих тимоцитов и обнаружили ещё не идентифицированный до этого ген белка из семейства иммуноглобулинов, который оказался причастным к запрограммированной гибели клетки.
Т. Хондзё назвал этот белок PD-1 (programmed cell death protein).
Впоследствии, в 1999 году, та же группа учёных показала, что нокаутные по этому гену мыши склонны к развитию аутоиммунных заболеваний, то есть протеин PD-1 непосредственно задействован в механизме негативной регуляции иммунного ответа. Более того, следующие исследования показали, что лиганды (белки, которые связываются с рецепторами) для PD-1 находятся в том числе и в опухолевых клетках, и именно такой механизм позволяет этим клеткам быть защищёнными от агрессивного действия Т-киллеров.
Кстати, Сидней Бреннер, Джон Салстон и Роберт Хорвиц, сотрудники лаборатории молекулярной биологии Кембриджского университета (Великобритания) – главные исследователи процессов апоптоза начиная с 1974 года, которым удалось обнаружить его генетические детерминанты и молекулярные механизмы, стали Лауреатами Нобелевской премии по физиологии и медицине в 2002 году.
После публикации работ П. Гольштейна с сотрудниками началось активное исследование белка CTLA-4 и его роли в торможении иммунного ответа. В 1992 году группа американских исследователей во главе с Липин Ченом (Онкологический центр Йельского Университета) показали, что при участии рецепторов CD 80 (86) (или B7) на поверхности антигенпрезентирующей клетки, а также CD28 и CTLA-4 – на Т-киллерах – происходит костимуляция противоопухолевого иммунитета.
Суть механизма отрицательной регуляции иммунного ответа при участии CTLA-4 раскрыли дальнейшие независимые исследования нескольких групп американских иммунологических лабораторий под руководством: 1) уже известного нам по изучению функции главного Т-клеточного рецептора Така Ва Мака, 2) Арлен Хелен Шарп (Гарвардская медицинская школа) и 3) Джеймса Эллисона (Онкологический центра Техасского университета), нынешнего нобелианта.
В 1995 году одновременно выходят их публикации о функциях этого белка. Оказалось, что CTLA-4 является рецептором с высоким сродством к рецептору CD 80 (86) (или B7) на поверхности антигенпрезентирующей клетки, связывание которого с корецептором CD28 Т-лимфоцитов приводит к активации этих клеток и запуску иммунной реакции.
А поскольку CTLA-4 найден только на активированных Т-клетках, то понятно, что они будут успешно конкурировать с CD28 за связывание с В7, чем будет разорван путь передачи положительного иммунного сигнала. После всех описанных исследований рецепторы CTLA-4 и PD-1 получили название контрольных иммунных точек.
В следующем, 1996 году, одна из трёх упомянутых лабораторий, которую возглавлял Джеймс Эллисон, сделала шаг, позволивший перевести накопленные знания об отрицательной иммунной регуляции на новый уровень. А именно, родилась идея «отпустить тормоза» иммунитета, с целью его противоопухолевой активации.
Что использовать в качестве блокираторов этих тормозов, на тот момент у Дж. Эллисона уже не вызывало вопросов, конечно же моноклональное антитело против CTLA-4. Его получили, ввели мышам с карциномой прямой кишки и наблюдали у них угнетение роста опухоли, что было следствием повышения активности Т-киллеров по отношению к раковым клеткам (повышение противоопухолевого иммунитета). Результаты были изложены в публикации 1996 года в журнале «Cell».
С этого момента начинается отсчёт истории противоопухолевой терапии с использованием моноклональных антител против контрольных иммунных точек. До тех пор в лечении онкологии использовали разработанные первыми гормональные препараты, а впоследствии и цитостатики – препараты из группы антиметаболитов, антагонистов пуринов (составляющих молекулы ДНК).
За разработку препарата с таким действием, меркаптопурина, Джордж Герберт Хитчинг (1905–1998 ) с коллегой Гертрудой Белл Элайон (1918–1999) в 1988 году получили половину Нобелевской премии по физиологии и медицине.
Идея производства лекарств противоопухолевого действия на основе моноклональных антител против контрольных иммунных точек принадлежит Дж. Элисону. С этой целью в 1997 году он подписывает контракт с небольшой биотехнологической компанией Medarex (Принстон, США), которая начинает работы по разработке анти-CTLA-4. После их получения наступает очередь клинических исследований.
В следующием, 1998-м, году руководство Medarex принимает решение начать производство анти PD-1 после получения разрешения от Т. Хондзё.
В 1999 году Medarex закончила работы по получению обоих видов моноклональных антител и приобрела на них права. В течение следующих 10 лет были проведены клинические опыты с использованием новых препаратов для лечения меланомы (агрессивного вида рака), рака легкого, почки, предстательной железы, а также рака головы и шеи. Но получить положительный эффект врачи смогли не сразу, так как использовали критерии оценки, разработаные для традиционной химиотерапии и целевых агентов. На первых этапах лечения новыми средствами наблюдался дальнейший рост опухоли.
Это происходит по двум причинам:1) либо из-за более медленного по сравнению с ростом опухоли формирования противоопухолевого иммунного ответа, или, 2) наоборот, быстрый иммунный ответ приводит к притоку иммунных клеток к опухоли, и образуется воспалительный отёк, создающий эффект ложного прогрессирования болезни.
В связи с этим были разработаны новые подходы к оценке эффективности использования новых препаратов. Использование новых критериев подтвердило более высокую выживаемость и снижение роста опухоли у онкологических пациентов при использовании антител к PD-1.
Только после получения стойкого положительного эффекта лечения рака новыми препаратами, в 2009 году, крупная фармацевтическая компания Bristol Myers Squibb (США) решает присоединить Medarex и вложить 2 млрд долларов для продолжения клинических исследований и продвижения созданных лекарств на медицинском рынке.
Уже через два года произошёл большой шаг в этом направлении, в 2011 году организация FDA (фармкологический комитет США) зарегистрировала два препарата, разработанные компанией, Ipilimumab (анти-CTLA-4) и Pembrolizumab (анти- PD-1). В 2016 году Pembrolizumab получил лицензию на территории Украины.
После длительного и изнурительного этапа создания, клинических исследований и даже судебных разбирательств, которые возникли в своё время в 2006–2008 годах из-за негативных последствий лечения новыми препаратами, начался период сбора престижных международных наград авторами метода торможения отрицательной иммунной реакции.
В 2014 году Джеймсу Эллисону и Тасуку Хондзё присуждается I международная премия Тан (Национальная академия наук Тайваня) в номинации «Биофармакология».
В 2017 году Джеймс Эллисон и Тасуку Хондзё разделили премию американского фонда Уоррена Альперта, присуждаемую в области создания новейших методов лечения болезней и расстройств у людей, ещё с тремя исследователями, которые сделали равноценный с ними вклад в изучение функций контрольных иммунных точек: Липиен Чен, Гордон Фримен и Арлен Шарп.
Как это нередко случается в истории науки, когда происходит огромный прорыв в создании новейших медицинских подходов для лечения тяжёлых заболеваний, Нобелевский комитет присуждает премии как за разработку самого метода в номинации «Физиология и медицина», так и за технологический вклад в создание препаратов, которые используются для этой новой терапии, в номинации «Химия».
И вот спустя два дня после объявления Лауреатов Нобелевской премии по физиологии и медицине, 3 октября 2018 года в 11.45 по Гринвичу Нобелевский комитет обнародовал имена лауреатов по химии. Половина этой премии была разделена между двумя учёными, о которых мы здесь рассказали, это Джордж Смит, автор метода фагового дисплея, и Георг Винтер – разработчик метода гуманизации мышиных моноклональных антител, двух методик, без которых было бы невозможным создание новых противоопухолевых препаратов.
Их Нобелевская медаль стала реверсом последней громкой и резонансной Нобелевской истории!
О.А. Гудкова, младший научный сотрудник, Институт биохимии им. А.В. Палладина НАН Украины
По теме:
|
Фритьоф Нансен: Чем длиннее и роскошнее хвост, тем короче крылья |
|
Законы природы: от необозримого космоса до элементарных кирпичиков всего сущего |









 Основатель и издатель
Основатель и издатель Copyright © 2016–2021 Научно-популярный
Copyright © 2016–2021 Научно-популярный