
Неизвестно, кто первый открыл воду,
Аркадий и Борис Стругацкие
но уж наверняка это сделали не рыбы.
1. ОСНОВНОЕ
Вода является самым распространённым веществом на Земле. Как известно, ¾ поверхности земного шара покрыты водою, заполняющей все природные водоёмы и образующей океаны, моря, реки и озёра. Много воды находится в газообразном состоянии в виде паров в атмосфере, огромными массами снега и льда лежит круглый год на вершинах высоких гор и в полярных регионах.
Вода совершает круговорот в природе. С поверхности морей и океанов вода интенсивно испаряется, образуя облака. Из туч вода проливается снова на Землю, просачиваясь сквозь почву, образуя большие подземные резервуары пресной воды. Из них берут начало реки.
Считается, что в водной среде произошла жизнь на планете Земля, и поэтому при изучении астрономами других планет первое, что ищут, это следы воды, чтобы с уверенностью сказать, возможна ли жизнь на данной планете. А ещё известно, что человек на 95% состоит из воды.
Давайте попробуем разобраться в свойствах такого обычного элемента нашей жизни.
2. ЧТО-ТО ИЗВЕСТНОЕ
Что мы знаем о воде? Вода является простейшим химическим соединением, состоящим из двух атомов водорода и одного атома кислорода. Вода может находиться в трёх агрегатных состояниях: твёрдом – лед, жидком – основное состояние воды и газообразном – водяной пар.
Люди интересовались водой с незапамятных времён. Ещё в IV веке до нашей эры греческий философ и учёный Аристотель провозгласил воду началом всех вещей. В течение многих веков воду считали простым веществом, которое не может быть разложено на составные части.
В 1665 году голландский учёный Кристиан Гюйгенс предложил принять воду за опорные точки шкалы термометра. В 1780 году английский физик и химик Генри Кавендиш, пропуская электрические искры в смеси кислорода и водорода, впервые получил воду, а французский химик Антуан Лавуазье в 1783 году вывел её формулу.
По причине большой распространённости воды в природе она стала эталоном для многих физических свойств. Плотность и вязкость воды приняты за единицу. Температура затвердевания воды принята за ноль, а температура кипения – за 100 градусов (по шкале Цельсия).
Широко распространённая до недавнего времени единица измерения тепловой энергии – калория, определялась как количество теплоты, требуемое для нагревания 1 грамма воды на 1 градус Цельсия.
3. КОЕ-ЧТО НЕИЗВЕСТНОЕ
Знаете ли вы, что вода обладает аномальными свойствами? Обычно, под аномальными свойствами понимают что-то совсем необычное. Вода обладает этими необычными свойствами, но, так как мы каждый день пользуемся водой, то уже не замечаем этих аномальных свойств.
Начнём. Физический закон гласит: тела при охлаждении сокращают свои размеры (сжимаются), а при нагревании – увеличивают размеры (расширяются). Это закон нормального теплового расширения. Однако, если мы рассмотрим свойства воды, то при охлаждении ниже +40С вода расширяется. Впервые на это необычное свойство воды обратил внимание итальянский астроном Галилео Галилей.

Если взять обычную воду и, постепенно охлаждая, следить за изменением плотности, то можно заметить, что в начале будет происходить совершенно обычный и естественный процесс – вода становится при охлаждении всё плотнее и плотнее, и никаких аномалий мы не увидим, до тех пор, пока не охладим воду до 40С.
Ниже этой температуры, вопреки общим представлениям, вода вдруг становится легче, а, замерзая, она делается ещё легче и образует лёд, который плавает по поверхности воды. Именно эта аномальная особенность воды предохраняет от сплошного промерзания в суровые зимы озёра и пруды.
Осенний воздух охлаждает поверхностные слои озера, они становятся тяжелее и опускаются на дно. Озеро охлаждается. Но этот процесс идёт лишь до тех пор, пока температура воды не достигнет 40С.
Если теперь поверхностные слои станут ещё холоднее, то они уже не опускаются на дно, так как плотность этих слоёв меньше плотности глубинной воды, где сохраняется температура 40С. Отличия в плотности невелики, они проявляются только в четвёртом знаке после запятой, но этих отличий вполне достаточно, чтобы вода с температурой, близкой к нулю не могла проникнуть в глубину озера.
У всех жидкостей вязкость возрастает с ростом давления, в то время как у воды вязкость уменьшается. Скорость звука в воде возрастает с ростом температуры (у всех других жидкостей – наоборот).
Основная электрическая характеристика любой среды – диэлектрическая постоянная (или диэлектрическая проницаемость) – в случае воды демонстрирует необычные для жидкости особенности.
Во-первых, диэлектрическая постоянная для воды очень большая. Во-вторых, при воздействии на любое вещество переменным электрическим полем, то диэлектрическая проницаемость перестаёт быть постоянной величиной и зависит от частоты поля. Однако, диэлектрическая проницаемость воды уменьшается в переменных полях.
Рассмотрим теперь химическую сторону.
По периодической таблице Дмитрия Ивановича Менделеева можно предсказать все свойства любого вещества, но вода и тут является исключением. В нашем случае из таблицы следует, что свойства водородных соединений элементов (называемых гидридами), расположенных в одних и тех же вертикальных столбцах, с ростом массы атомов должны изменяться монотонно.
Кислород – элемент шестой группы этой таблицы. В этой же группе находятся сера S (с атомным весом 32), селен Se (с атомным весом 78), теллур Te (с атомным весом 127) и полоний Po (с атомным весом 209). Следовательно, свойства гидридов этих элементов должны меняться монотонно при переходе от тяжёлых элементов к более лёгким, т.е. в последовательности:
H2Po → H2Te → H2Se → H2S → H2O.
Что и происходит, но только с первыми четырьмя гидридами. Например, температуры кипения и плавления растут при увеличении атомного веса элементов:
Tкип – -2ºC и Tпл – -51ºС для H2Te,
Tкип – -42ºC и Tпл – -65ºС для H2Se,
Tкип – -60.38ºC, Tпл – -85.6ºС для H2S.
Если бы гидрид кислорода H2O был «нормальным» соединением, похожим на своих соседей по шестой группе, то жидкая вода существовала бы в диапазоне от –800С до –950С. При более высоких температурах вода всегда была бы газом.
Ещё более загадочны биологические свойства воды: ведь именно вода обуславливает существование жизни на Земле. Без пищи человек может прожить два месяца, но без воды он не проживёт и пяти дней.
С другой стороны, вода может оказаться и носителем смертельной опасности. В непроточной, грязной воде интенсивно размножаются микроорганизмы, и не только полезные. В прошлом из-за такой воды возникали эпидемии различных болезней. В настоящее время в каждом городе стоят водоочистительные станции.
4. А МОЖНО ЛИ ЭТО ОБЪЯСНИТЬ?
В попытках объяснить удивительные свойства воды было предложено несколько десятков гипотез и моделей. Разные учёные пытались объяснить аномальные свойства с позиций строения воды. Но оказалось, что каждая из моделей хорошо может объяснить одно или несколько свойств, но не может объяснить другие свойства или особенности воды.
Все аномальные свойства воды говорят о том, что молекулы воды очень прочно связаны между собой. Скорее всего, они образуют какую-то конструкцию из молекул, которая сопротивляется любым внешним разрушающим воздействиям – тепловым, электрическим, механическим.
Это объясняет, почему нужно подвести так много тепла к воде, чтобы перевести её в пар. В 1920 году американские учёные У. Латимер и У. Родебуш предложили назвать эти особые связи водородными, которые, как они считали, являются ключом к пониманию особых свойств воды.
Водородная связь – это вид химической связи, A – H…B, в которой атом водорода, соединённый ковалентной связью с электроотрицательным атомом А (углерод, азот, кислород, сера), образует дополнительную, сравнительно прочную связь с атомом В (азот, кислород, сера).
Важное свойство водородной связи заключается в кооперативности и означает, что образование одной водородной связи способствует возникновению рядом следующей связи, которая, в свою очередь, способствует образованию следующей и так далее.
Физико-химическая природа кооперативности состоит в том, что две молекулы H2O, образуя водородную связь, вступают в кислотно-щелочное взаимодействие, в результате которого одна молекула становится более кислой, а другая – более щелочной. Поэтому для образования этими же молекулами и других водородных связей требуется меньше энергии.
Учёные сделали вывод: чтобы разобраться в аномальных свойствах воды, необходимо, прежде всего, понять, что такое водородная связь. Но можно возразить, что много других молекул, например, аммиак NH3 или фтористоводородная кислота HF тоже могут образовывать водородные связи, но они не обладают аномальными свойствами.
В чём же дело?
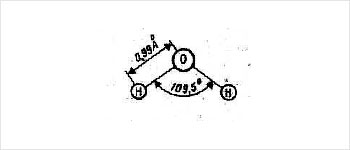
Двести лет назад было установлено, что молекула воды состоит из трёх атомов: одного атома кислорода и двух атомов водорода. В наше время точных методов физических исследований удалось установить, что длина каждой связи O – H равна 0,99 Ангстрем (1 Ангстрем=10-10 м), а угол между этими связями равен 109,5º. Если рассматривать молекулу воды в одной плоскости, то можно нарисовать симметричную молекулу, однако, можно заметить, что она однобока.
Как известно, атомы в молекулы объединяются с помощью своих электронов. Давайте рассмотрим образование молекулы воды. На последней орбите кислорода находится 4 свободных электрона.
У водорода имеется всего лишь одна электронная орбита, на которой находится единственный электрон. Итак, мы имеем всего 6 электронов – 4 электрона у кислорода и 2 электрона у двух атомов водорода. Чтобы соединить два атома водорода с одним атомом кислорода, достаточно двух связей. В образовании ковалентной связи O – H участвует единственный электрон атома водорода и один электрон атома кислорода.
А что же «делают» два оставшихся электрона кислорода?
Если мы рассматриваем одну изолированную молекулу H2O, эти электроны остаются свободными, никак не участвуя в образовании молекулы воды. За это они получили название «неподеленной пары».
Каждый из протонов – водородов любой молекулы воды может прочно связываться с неподеленным электроном другой молекулы и образовывать новую водородную связь. При этом первая молекула оказывается донором, а вторая – акцептором.
Два протона плюс два неподеленных электрона приводят к выводу о том, что каждая молекула воды может участвовать в четырёх водородных связях, которые может образовать одна молекула. Таким образом, молекулы соединяются между собой при помощи «цепочки водородных связей».
Разобравшись немного в водородных связях, можно браться за теории. Учёные объясняют все аномальные свойства воды тем, что большая часть молекул воды соединена водородными связями. Если бы их не было, то вода кипела бы при минус 95 ºС.
Энергия водородных связей достаточно велика, и разорвать их можно лишь при значительно более высокой температуре. Даже в газообразном состоянии большое число молекул H2O сохраняет свои водородные связи, объединяясь в пары – димеры. Полностью водородные связи исчезают только при температуре водяного пара 6000С.
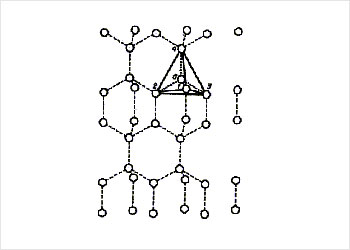
упорядоченную структуру,
похожую на объёмное кружево
А как же изменение свойств воды при переходе лёд – вода? Неужели это тоже можно объяснить водородными связями? Не совсем.
В твёрдом состоянии вода – лёд – имеет упорядоченную структуру, похожую на объёмное кружево, схематически изображённое на рисунке. При постепенном нагревании льда происходит разрушение рисунка кружева.
Если в твёрдом состоянии в пустотах ажурной конструкции может свободно помещаться одна молекула H2O, то при нагревании такие пустоты начинают заполняться молекулами воды. При этом плотность должна увеличиваться. Так и происходит, но только до 40С.
Выше этой температуры плотность уже не растёт, а начинает уменьшаться. Может быть при данной температуре все полости уже заполнены? Нет, объяснение другое.
Несмотря на то, что молекулы воды образуют уникальную ажурную структуру, это не избавляет их от необходимости следовать законам молекулярно-кинетической теории – при нагревании любого вещества скорость движения молекул этого вещества возрастает, что приводит к расширению всего объёма.
В нашем случае это означает, что во время нагревания воды идут два процесса – заполнение пустот и обычное термическое расширение воды. В интервале температур от 00С до 40С преобладает первый процесс и поэтому плотность воды увеличивается. Выше 40С преобладает второй процесс – плотность воды уменьшается.
В заключение хочется сказать, что ещё не все аномальные свойства воды изучены достаточно хорошо. Несмотря на то, что в настоящее время существует много теорий воды, учёные продолжают изучать её свойства и структуру.
5. А ЭТО ИНТЕРЕСНО
Не всем, наверное, известно, что при определённых условиях вода может существовать сразу в трёх агрегатных состояниях. Жидкая вода, лёд и пар находятся в равновесии при давлении 600 Па и температуре 0,010С.

В настоящее время известно 9 модификаций льда. У них различные кристаллические решётки (ажурный рисунок), различные плотности и температуры плавления. Всем нам хорошо знакомый лёд называется «лёд I». Другие модификации льда существуют при давлениях, превышающих 2 000 атмосфер.
Например, лёд III, образующийся при давлении 2115 атмосфер, тяжелее воды, а лёд VI (при давлении около 20 000 атмосфер) плавится при температуре, превышающей 800С.
Сказочные термины «живая и мёртвая вода» всё чаще используются в повседневной жизни. Термин «живая вода» часто используется в рекламе фильтров и устройств для очистки воды. Он означает воду, содержащую ионы серебра, которые способствуют обеззараживанию воды, заживлению ран.
Термин «мёртвая вода» означает воду, которая не содержит совершенно никаких примесей, например, дистиллированная вода, либо такой термин можно применить к воде Мёртвого моря, которая содержит такое большое количество минеральных солей, что в ней не могут жить никакие живые организмы, даже бактерии.
А.В. Хлюстова, канд. хим. наук, Институт химии растворов РАН









 Основатель и издатель
Основатель и издатель Copyright © 2016–2021 Научно-популярный
Copyright © 2016–2021 Научно-популярный