
Dum spíro, spéro
пока дышу, надеюсь
Часть I. Кислород и жизнь
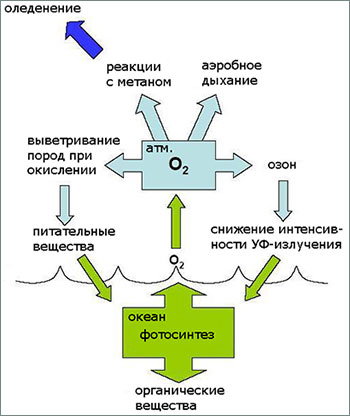
Кислород и жизнь неразрывно связаны друг с другом с самых далеких времён существования Земли. Но сначала была всё-таки жизнь в виде первых микроорганизмов, архебактерий, которые появились около 3,5 млрд. лет назад и были способны к фотосинтезу.
Основу атмосферы планеты тогда составляли углекислый газ, сероводород, аммиак и метан. Бактерии, связывая углекислый газ под воздействием солнечного света, запасали себя энергией. Изменение химического состава океана в результате угасания вулканической активности Земли заставило приспосабливаться микробное сообщество планеты к новым условиям, и приблизительно 2,5 млрд. лет назад, фотосинтез стал протекать с образованием свободного молекулярного кислорода.
Так жизнь породила кислород, и произошла кислородная катастрофа. Почему этот переломный этап в существовании планеты называется кислородным понятно, но почему катастрофой – не совсем. Ведь со временем, спустя ещё 1 млрд. лет после своего появления, кислород стал накапливаться в атмосфере, кардинально изменив её состав, что способствовало формированию буферных свойств газовой оболочки Земли и исчезновению парникового эффекта на нашей планете, и, собственно с того момента зародилась жизнь в новом своем качестве.
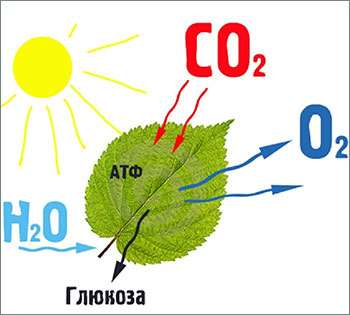
Бактерии, способные к кислородному (оксигенному) фотосинтезу, стали вытеснять своих аноксигенных собратьев по одной простой причине, что аэробное клеточное дыхание – клеточный катаболизм с использованием молекулярного кислорода – оказалось гораздо более выгодным по сравнению с анаэробным. А выживает, как известно, тот, у кого дольше работает «батарейка».
И со временем подавляющую часть биосферы стали составлять организмы, способные к аэробному существованию, одни связывая углекислый газ атмосферы, выделяли в неё кислород, а другие использовали его для дыхания, обеспечивая себя энергией жизни.
Только с использованием свободного молекулярного кислорода для дыхания жизнь вышла на новый уровень и наполнилась новыми формами.
Но как водится, розы без шипов не бывает. Не всё оказалось так радужно и с появлением свободного молекулярного кислорода в атмосфере Земли.
А всё из-за того, что этот элемент обладает свойствами сильнейшего окислителя, образуя оксиды металлов, неметаллов и органических веществ (за что и получил свое название «кислород» – элемент, образующий кислоту, окисляющий), кроме того он воспламеняется и взрывоопасен.
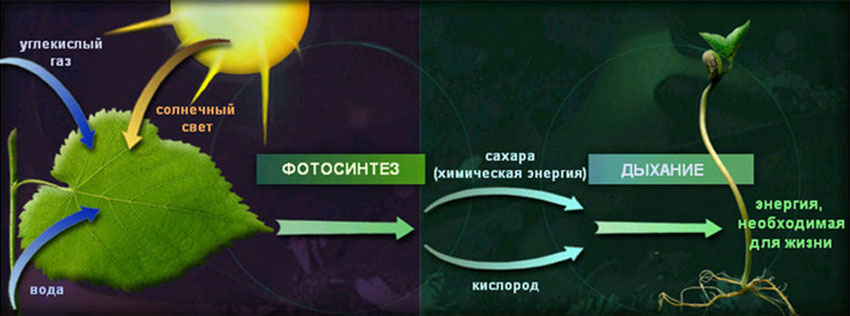
И самое главное, что в процессе клеточного дыхания кислород может создавать серьёзные проблемы для существования самой клетки. Это связано с особенностями структуры молекулы кислорода, которая имеет на своей внешней орбите только два неспаренных электрона.
Для полного счастья, то есть нейтрального существования, кислороду необходимо ещё четыре электрона и два протона (ионы водорода), которые он захватывает постепенно по одному после высвобождения их в реакциях митохондриальной дыхательной цепи, и превращается в молекулу воды – конечный продукт своего полного восстановления.
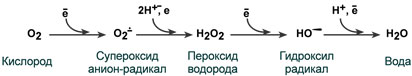
Но в действительности происходит «утечка» электронов из этой отлаженной цепи, и образуются продукты неполного восстановления кислорода.
Эти соединения с одним неспаренным электроном на внешней орбите обладают ещё более высокой активностью, чем сам молекулярный кислород, и называются активными формами кислорода (АФК). АФК вступают в реакцию со структурными компонентами клетки (липидами, белками и ДНК), превращая их в органические радикалы, которые в свою очередь атакуют и повреждают другие молекулы.
Тем не менее, такой процесс является вполне физиологически нормальным, поскольку существование этих мелких разрушителей в клетке оправдано необходимостью борьбы с болезнетворными бактериями и ненужными веществами, попавшими в организм извне, или нужными, но уже отслужившими свой срок.
Правда, в некоторых случаях количество разрушающих соединений кислорода может, вдруг, резко увеличиться и возникнет опасность повреждения ими жизненно необходимых клетке биомолекул.
Чтобы этого не случилось, клетки выработали надёжную и очень мощную систему поддержания концентрации АФК в безопасных пределах. Система обезвреживания АФК называется антиоксидантной, является многоуровневой и состоит, как из ряда специальных белков – ферментов, так и из мелких молекул неферментативной природы, например, некоторых витаминов.
К группе АФК относят синглетный кислород (кислород в возбужденном состоянии, в которое он переходит под действием света), супероксидный радикал (О2-•), перекись водорода (Н2О2) и гидроксильный радикал (ОН•).
В том порядке, как они здесь перечислены, происходит их превращение друг в друга в цепи последовательных биохимических реакций с участием антиоксидантных ферментов: супероксид-дисмутаза превращает супероксид-анион в перекись водорода, которая затем разлагается другим ферментом – каталазой до молекулярного кислорода и воды, нетоксических продуктов, в чём и состоит суть защитного действия этих ферментов.
Супероксид-дисмутаза
2O2– + 2H+ → O2 + H2O2;
Каталаза
2H2O2 → 2H2O + O2.
Перекись водорода, которую не успела разложить каталаза, в присутствии ионов железа (Fe2+) без участия ферментов образует гидроксил-радикал – самый сильный и опасный из всех АФК.
Fe2+ + H2O2 → Fe3+ + 0H• + OH–.
Таким образом, мы видим двуликость кислорода, элемента, без которого невозможна жизнь. С одной стороны, он необходим для дыхания – главного физиологического процесса, а с другой стороны, может стать разрушителем внутри клетки, инициируя АФК.
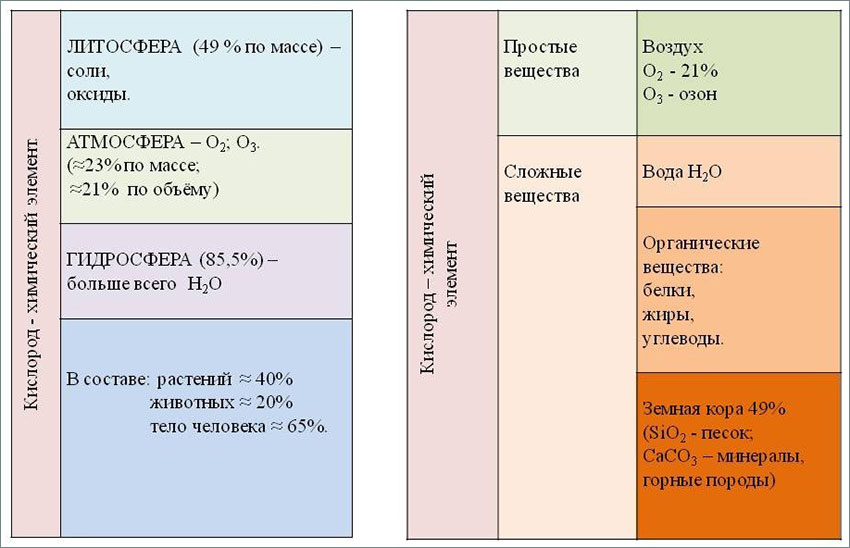
Итак, кислород – самый распространённый на Земле элемент. На его долю (в составе различных соединений, главным образом силикатов), приходится около 49% массы твердой земной коры.
Морские и пресные воды содержат огромное количество связанного кислорода – 85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по объёму и 23% по массе. Более 1500 соединений земной коры в своём составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 20%, по массовой доле – около 65%.
В сутки человек вдыхает 20–30 куб. м воздуха. В зависимости от интенсивности нагрузки меняется потребность в кислороде. В спокойном состоянии человеку необходимо около 25 л кислорода в час.
В атмосфере содержание кислорода в среднем составляет около 21 %. В одних местах его больше, это городские парки (20,8%), лес (21,6%), морской берег и подножие гор (21,9%), а вот в квартире и офисе – менее 20%.
В открытом пространстве дефицит кислорода возникает по техногенным причинам (автомобильный транспорт, промышленные выбросы и другие загрязнения). В закрытом помещении концентрация кислорода снижается по физиологической причине, ведь с каждым вдохом человек расходует этот газ, а при выдохе наполняет воздух углекислым газом СО2.
Иногда в офисах содержание кислорода падает до 18–19 %, и этот уровень является минимально допустимым для организма. Опасно низким уровнем содержания кислорода в воздухе считается значение ниже 16%, при этом наблюдается головокружение, учащённое дыхание, при 13% – потеря сознания, при 12% – необратимые изменения функционирования организма, при 7% – смерть.
Уже доказано, что снижение содержания кислорода на 1% приводит к снижению работоспособности на 30%. Пребывание человека в помещениях с таким воздухом сопровождается быстрой утомляемостью, сонливостью, снижением умственной активности, головными болями.
Длительное пребывание в помещении с недостаточным уровнем содержания кислорода может привести к более серьёзным проблемам со здоровьем.
Поскольку кислород отвечает за все обменные процессы организма, то следствием его недостатка становятся нарушение обмена веществ и снижение иммунитета. Теперь понятно, почему настолько жизненно важно поддерживать нужную концентрацию кислорода в жилых и рабочих помещениях.
Но, согласитесь, бывают ситуации, когда проблему дефицита кислорода невозможно решить простым проветриванием помещения. Например, на подводной лодке, на космической станции или при снижении содержания кислорода в окружающей атмосфере. А такая процедура экстренной медицины как кислородная терапия?
В последнее время всё большую популярность набирает использование кислорода в диетологии и косметологии. Мы сейчас не говорим об остальных аспектах использования кислорода в народном хозяйстве и науке, упоминая только о тех, что непосредственно связаны с жизнью и здоровьем человека.
Но и с этой точки зрения, как видно, уровни потребности в кислороде отличаются весьма сильно. Поэтому существуют различные способы получения этого газа, как промышленные, так и лабораторные. И дальше речь пойдет об одном из способов получения молекулярного кислорода в лабораторных условиях. Нам хотелось бы рассказать, как родилась эта идея и как была воплощена в жизнь.
Часть II. Кислородный реактор
Все гениальные идеи рождаются не на пустом месте, они появляются в умах учёных после долгих лет фундаментальных исследований, когда накоплен большой багаж знаний и проведено множество серий опытов. Так было и в случае с кислородным реактором.
В этом месте нам придётся напомнить читателю несколько моментов, о которых шла речь выше, а также в предыдущих заметках о разработках нашего отдела (на тот момент отдел биосинтеза и биологических свойств белка), которыми занимались Рита Григорьевна Дегтярь, Людмила Васильевна Гудкова и Нели Васильевна Латышко.

(1881-1955),
британский бактериолог
Но начнём историю этой разработки с ещё более ранних и масштабных событий. В конце 20-х годов в мировой науке и медицине произошёл революционный переворот: британский бактериолог Александр Флеминг открыл пенициллин – антибактериальное вещество, вырабатываемое микроскопическими плесневыми грибами рода Penicillium.
Флеминг опубликовал работу о своей находке в 1929 году, а потом долгих 16 лет шла работа по очистке и выделению пенициллина в кристаллическом виде, которую удалось завершить только с помощью двух других ученых-фармакологов Говарда Флори и Эрнста Б. Чейни лишь в 1945 году. В 1945 году всем троим учёным была присуждена Нобелевская премия в области медицины.
Институт биохимии Академии наук Украины всегда был и остаётся на передовых рубежах мировой науки, не стоял он в стороне и в этот исторический момент революционного открытия.
Спустя всего несколько лет после официального признания пенициллина мощным антимикробным веществом, что совпало с окончанием Великой Отечественной войны и началом восстановления страны после разрухи, учёные нашего института под руководством Максима Федотовича Гулого также начали выделять белки из микроскопических грибов рода Penicillium.
Все эти микроорганизмы вырабатывают ряд белков – ферментов, которые вместе с продуктами катализируемых ими биохимических реакций проявляют антибактериальные свойства.
Выращиванием и селекцией микробиологического сырья занимались коллеги из Института микробиологии и вирусологии Академии наук УССР под руководством Пидопличко Николая Макаровича и Билай Веры Иосифовны. Учёным-микробиологам удалось селекционировать новый штамм гриба этого вида, который назвали Penicillium vitale Рidoplichko et Bilai. Его особенностью было то, что гриб в процессе своей жизнедеятельности продуцирует два важных фермента: глюкозооксидазу и каталазу, большую часть которых он выделяет в окружающую его среду.

микроскопических грибов
в чашках Петри
До того времени, когда проходили эти события, микроскопические грибы выращивали в специальной стеклянной посуде (чашке Петри), поверхность которой была покрыта твердой питательной средой (агар-агар).
Этот способ культивирования был низко продуктивным. Для преодоления такого недостатка коллеги-микробиологи разработали и запатентовали способ глубинного культивирования этого штамма гриба.
Он заключался в том, что гриб P. vitale Рidoplichko et Bilai помещают в ёмкости с жидкой питательной средой комбинированного состава, которые постоянно встряхиваются на специальных устройствах (колбы на качалках).
Здесь он начинает бурно расти и заполняет среду культивирования продуктами жизнедеятельности (культуральная жидкость). Такой способ культивирования позволял расширить наработку ферментов до промышленных масштабов.

микроскопических грибов
в колбах на качалках
В 1948 году, когда получили штамм гриба P. vitale Рidoplichko et Bilai, глюкозооксидаза была первым ферментом, обнаруженным в его культуральной жидкости, а каталазу нашли несколько позже.
Мы уже рассказывали о том, как Дегтярь Р.Г. в 1949 г. получила очищенную глюкозооксидазу, а затем в 1965 г. вместе с Гудковой Л.В. им удалось выделить и очистить из того же источника и каталазу.
Людмила Васильевна Гудкова лично получала кристаллы каталазы, изучала их строение под микроскопом и делала их фотографии. Потом была разработана и внедрена в производство технология получения и очистки из одного микробиологического сырья двух ферментов в чистом кристаллическом виде. Для этих целей был построен ферментный цех на Каменском спиртзаводе в с. Косары Черкасской области.
По уровню чистоты, стабильности и активности этим препаратам не было равных на мировом рынке. Все упомянутые работы в разные годы были отмечены Государственными премиями и дипломами.
Теперь остановимся подробнее на особенностях белка – фермента каталазы. В начале статьи, когда речь шла о защитных свойствах клетки от пагубного воздействия кислородных радикалов, мы упоминали о каталазе как ферменте, в присутствии которого перекись водорода в живой клетке разлагается на молекулярный кислород и воду.

из гриба Penicillium vitale
Реакция описывается следующим уравнением:
2Н2О2 → 2Н2О + О2.
И вот, в конце 1980-х – начале 1990-х годов, когда успешно работало производство по получению кристаллических препаратов глюкозооксидазы и каталазы, у Гудковой Л.В. родилась идея: получать кислород в чистом виде с помощью препарата каталазы!
От высоты замысла появился и масштаб применения: космонавтика, подводный флот, горнодобывающая промышленность (шахты), а также зарождающееся производство экологически чистых электромобилей! Всё соответствовало духу времени. Но главное, был огромный энтузиазм, багаж знаний, силы, средства и возможности осуществить задуманное.
Механизм действия каталазы как катализатора распада перекиси водорода на кислород и воду, безусловно, уникальный, но как его использовать в условиях лаборатории, чтобы сделать прибор или установку непрерывного действия с возможностью сбора образованного кислорода в специальные резервуары? И началась кропотливая работа.
каталазы и глюкозооксидазы
Penicillium vitale
Первой трудностью оказалось то, что каталаза относится к классу суицидных ферментов, белков-самоубийц. Что это значит, спросите Вы?
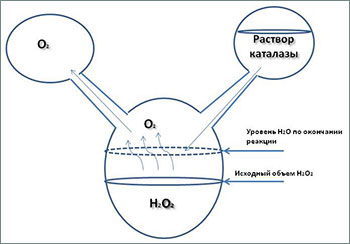
А значит это то, что каталитическое действие фермента направлено на перекись водорода, которая, в данном случае, выступает субстратом реакции, но является, по сути, очень мощным окислителем. Каталаза с невероятно высокой скоростью выполняет огромное число каталитических циклов, в каждом из которых превращает две молекулы перекиси в две молекулы воды и одну молекулу кислорода.
Но если концентрация перекиси будет очень высокой, то фермент не будет успевать её разлагать и подвергнется окислительному действию собственного субстрата и при этом пострадает структура молекулы, а значит способность к катализу. Теоретически можно приготовить раствор перекиси водорода подходящей концентрации, рассчитать её такой, чтобы белок мог работать определенное время.
Поместить в колбу этот субстрат и подавать туда частями каталазу, раствор которой готовится на подходящем для проведения реакции буфере (растворе определенной ионной силы и рН). Образующийся кислород будет подниматься над жидкостью, и его можно собрать через отводную трубку. В колбе к концу подачи последних порций каталазы останется только чистая вода.
кислородного реактора
Хорошая идея? Замечательная!!
Но тут же открылась следующая трудность. Реакция, о которой идет речь, является экзотермической, т.е. протекает с выделением тепла. В условиях in vivo (в живой клетке) в виду того, что разлагаются небольшие количества перекиси водорода и только в случае их локального переизбытка (а происходит это быстро и оперативно), экстремального перегрева не будет.
Но если реакцию проводить в пробирке с достаточно большим количеством субстрата, интенсивный катализ будет сопровождаться выделением такого количества тепла, которое превысит физиологическую температуру (370 С) в 1,5, а то и в 2 раза. Но при высоких температурах, как известно, белки денатурируют необратимо, нарушается их третичная и четвертичная структура.
Вот и выходит, что получение больших количеств молекулярного кислорода сопряжено с ограниченными возможностями самого белка каталазы, он неустойчив к воздействию высоких концентраций собственного субстрата и выделяемого в ходе реакции большого количества тепла.
И тогда Людмила Васильевна придумала конструкцию этой установки, всё рассчитала: концентрацию перекиси, концентрацию раствора каталазы, а также возможность контролировать температуру в реакционной среде и собирать кислород при помощи газоотвода.
Всё заработало, раствор каталазы подавали дозировано через кран, при перегреве подачу вовсе прекращали до нормализации температуры. Но время работы такого реактора ограничивалось его объёмом, ведь он наполнялся постепенно образующейся в ходе реакции водой. И, тем не менее, идея заработала!
Собственно говоря, неустойчивость ферментов при использовании их для получения продуктов реакции в лабораторных, а со временем и промышленных условиях (биотехнология) всегда была главной проблемой этой отрасли.
Ещё в 1916 году британские ученые Дж. Нельсон и Е. Гриффин придумали, как обойти эту трудность. Они адсорбировали на уголь фермент инвертазу, которым в то время занимались и с её помощью получали из сахарозы глюкозу и фруктозу. Дж. Нельсон и Е. Гриффин использовали уголь, со временем спектр материалов носителей, на которые можно было посадить (пришить) молекулы фермента, расширился.
Для этих целей стали применять природные полисахариды и синтетические носители полиметильного типа, сефадексы, агар и т.п. Фермент жёстко «пришивался» к неподвижной органической матрице, полимеру, у которого есть много участков для соединения с молекулой белка.

и иммобилизованный фермент (б)
Большая площадь поверхности носителя и наличие свободных аминогрупп для образования жёстких связей с молекулой фермента дают возможность получить достаточный объём нерастворимого, а значит мало уязвимого фермента, который способен долго храниться до использования и выдержать огромное число каталитических циклов в биотехнологическом производстве.
Этот метод назвали «иммобилизация», т.е. связывание, ограничение подвижности. В 1960-х годах изучение и использование иммобилизации набрало мощные обороты и уже в 1969 году в Японии впервые было запущено производство с этой технологией. В 1971 году официально узаконен термин «иммобилизованный фермент».
Наблюдая за упорными поисками Людмилы Васильевны, своей ученицы и коллеги, Рита Григорьевна для преодоления трудностей в создании кислородного реактора предлагает использовать метод иммобилизации, который к этому времени в группе стали активно изучать и искать носители для каталазы и глюкозооксидазы. Такие материалы были успешно найдены, опробованы и на их основе получены оба иммобилизованных фермента.
Преимуществом применения иммобилизованных ферментов в биотехнологии является возможность их длительного хранения и многократного использования без риска потери функциональности за счет нарушения структуры, ведь жёсткая органическая матрица, с которой связан фермент, экранирует белок от пагубных воздействий.
Итак, найден выход!
В итоге определились с концепцией реактора. В ёмкость самого реактора помещался иммобилизованный фермент в определенном объёме буфера, который служил также для поглощения части выделяемого в ходе реакции тепла. Реактор имел вход для регулируемой подачи субстрата (перекиси водорода определённой концентрации) и два отвода: один для улавливания кислорода и другой для слива лишней жидкости. Для надёжного охлаждения реактор помещали в резервуар с водой.
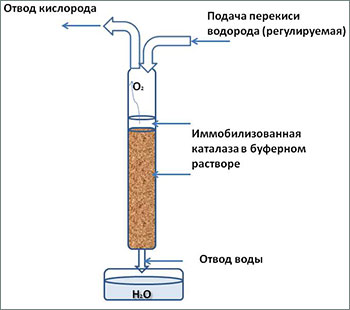
Уникальность подобной установки заключается в том, что для её работы используются компоненты отечественного производства самого высокого качества (фермент в кристаллическом виде, анионный носитель для иммобилизации и перекись водорода). Себестоимость, соответственно, невысокая, а продуктивность ограничена только потребностями в процессе эксплуатации.
За время, пока шла эта работа, произошло много драматических событий и в судьбах наших героев, и в судьбах страны, которые затормозили весь процесс создания кислородного реактора, но его всё-таки удалось запатентовать!
И вот сейчас, 25 лет спустя, было решено реанимировать эту идею. Усовершенствована конструкция реактора, создано несколько её разновидностей в зависимости от цели и области применения, доработаны детали, восстановлены авторские права.
Теперь у нас есть возможность получать чистый молекулярный кислород на портативной установке разных модификаций для лабораторных, бытовых и лечебных целей. При помощи этой установки без затрат электроэнергии можно получать до 10 л кислорода в час!
Идея получения молекулярного кислорода, о которой мы рассказали, прошла испытание временем, пережила годы забвения и обрела второе дыхание. Иначе и быть не может, ведь в основе самой идеи лежит неразрывная связь кислорода и жизни, и эта связь настолько глубока и востребована, что сама будет требовать завершения работы над проектом.
О.А. Гудкова, ведущий инженер отдела регуляции обмена веществ Института биохимии им. А.В. Палладина НАН Украины









 Основатель и издатель
Основатель и издатель Copyright © 2016–2021 Научно-популярный
Copyright © 2016–2021 Научно-популярный