
История открытия последнего из известных на сегодня витаминов, В12, напоминает сложную многоходовую шахматную партию между жизнью и смертью.
Она продолжалась больше 100 лет, пока всем учёным и врачам, подобно гроссмейстерам международного уровня, игравшим в этой партии белыми фигурами жизни, не удалось победить своего чёрного противника – пернициозную анемию, смертельное заболевание крови, связанное с изменением качества этой жидкой ткани человеческого организма.
Сложность этой истории была во всём: в симптомах заболевания, в фатальности исхода, особенности функционирования систем организма, вовлечённых в болезнь, не говоря уже о химическом строении молекулы открытого соединения, витамина В12, оказавшегося, как и все остальные витамины, фактором пищи. Поэтому придётся окунуться как в исторические события, так и в некоторые теоретические знания.
Пожалуй, сегодня практически каждому известен термин «анемия», который в переводе с древнегреческого дословно означает «некровь» (ἀν – приставка со значением отрицания и αἷμα «кровь») или, в более приемлемой для нас адаптации, «малокровие».
Анемия сопровождает человечество на протяжении всей его истории, ведь в борьбе за выживание в дикой природе, а позже и во время военных событий, люди были подвержены ранениям с сопутствующей кровопотерей разной степени тяжести. Кровь, конечно же, способна к самовосстановлению, но для этого требуется время. Длительность такого периода зависит от количества потерянной крови и индивидуальных возможностей конкретного организма, а весь восстановительный период сопровождается анемией.
Анемия, описанная ещё в середине XVI века, проявлялась бледностью кожи с зелёным оттенком, сердцебиениями, одышкой и отвращением к мясной пище.
Обратите внимание, что среди симптомов присутствует один, относящийся к питанию. То есть, ещё в далёкие времена появилось предположение о связи анемии также и с качеством питания. Поскольку кровь здорового человека обладает ярко-красной окраской и определённой плотностью (густотой), то для проверки её качества у людей с описанными симптомами врачи в доисторические времена, возможно, прибегали к флеботомии (кровопусканию), обнаруживая при этом гораздо более бледную и жидкую кровь своих пациентов.
Но со временем среди пациентов с анемическим синдромом выделили таких, у которых также наблюдались чрезвычайная слабость и бледность кожи, но при этом бледность была другого оттенка, грязного, даже землистого, покрывавшая кожу и слизистую оболочку (главным образом дёсна) пятнами, но главное – у этих пациентов не было ранее обильных кровотечений и кровопотерь.
Первым такую особенную форму анемии описал Джеймс Скарт Комб из Эдинбурга (Шотландия) в 1824 году, но больше к изучению этого заболевания не возвращался.

Более подробное описание страшного недуга было сделано известнейшим английским врачом знаменитой Лондонской больницы Гая Томасом Аддисоном (1793–1860), непревзойдённым диагностом, клиницистом и лектором своего времени.
Он с 1843 года занимался изучением особой разновидности анемии у пациентов в возрасте от 20 до 60 лет. При этом, к уже перечисленным симптомам (слабости, одышке, сердцебиению) добавлялись ещё такие, как специфическая пигментация кожи, глоссит (воспаление языка), анорексия (неприятие пищи), диарея, а со временем развивалось нарушение координации движений, деменция и, в финале, – смерть…
Безысходность болезни и отсутствие методов её лечения вызывала страх не только у пациентов, но и у врачей, считавших эту анемию страшнее злокачественной опухоли, которую хотя бы можно было удалить хирургическим путём. Иногда в медицинской литературе этот диагноз ещё фигурировал как «злокачественная анемия».
В книге, опубликованной в 1855 году, Т. Аддисон пишет, что данная разновидность анемии удивительна тем, что у неё нет видимых причин: предшествовавших заболеванию обильных кровопотерь, хлороза, пурпура (склонность к кровотечениям), продолжительной диареи, болезни селезёнки, почек, внутренних желез, а также онкологии. Но всех пациентов объединяло то, что это были взрослые люди, и то, что в каждом случае исход был один – летальный. Из-за отсутствия видимых причин он назвал эту форму анемии «идиопатической», т.е. неопределённой, неясной.
К сожалению, Томас Аддисон был к этому времени серьёзно болен и через 3 года вынужден был прекратить преподавание и врачебную практику, а в 1860 году выдающийся врач-учёный скончался, оставив после себя яркий след в медицине. Но после него в Великобритании больше никто не исследовал это опасное заболевание.

(1827–1892)
Зато работа по изучению и анализу идиопатической анемии была продолжена в Медицинском центре Цюрихского университета (Швейцария) немецким профессором медицины Михаэлем Антоном Бирмером (1827–1892). Он описал гораздо более подробно симптомы всех случаев, с которыми он столкнулся на практике. Вкладом Бирмера в изучение этого заболевания стала констатация того факта, что оно является прогрессирующим и пернициозным (от лат. perniciosus – гибельный, опасный) в связи с фатальным (смертельным) исходом, о котором писал ещё Т. Аддисон.
С того момента эта патология стала называться прогрессирующей пернициозной анемией, или болезнью Аддисона-Бирмера. Кроме того, анализ всех случаев заболевания позволил Бирмеру предположить, что одной из причин могут быть тяжёлый труд в условиях мощно развивающейся в то время промышленной индустрии и обнищание рабочих, в результате чего их питание становилось невероятно скудным. И этот вывод вновь делает акцент на связи грозного заболевания с питанием.
Несмотря на то, что анемия – это заболевание крови, самого-то описания её состояния ни Томас Аддисон, ни Михаэль Бирмер и не проводили. И были на это объективные причины.
Для полноценного исследования состояния крови, как мы сегодня уже знаем, необходим микроскопический анализ специальным образом приготовленных образцов. Хотя в середине XIX века микроскоп уже активно использовался в науке и медицине, но ещё не были разработаны методики окрашивания биологического материала, позволявшие оценить количественно и качественно состав крови.

(1632–1723)
О том, что в крови человека находятся красные «корпускулы» (тельца круглой формы) первым сообщил в далёком 1695 году известный голландский микроскопист Антони ван Левенгук (1632–1723), член Лондонского Королевского общества.
Красные кровяные шарики впоследствии были названы эритроцитами (греч. eruthrós – «красный », κΰτος kytos – «сосуд», «клетка») и были первыми обнаруженными клетками крови.
Вот теперь стало понятно, что цвет крови дают именно эритроциты, в смысле вещество, которое в них содержится. Но что же оно из себя представляет?
В 1826 году немецкий химик Иоганн Фредерик Энгельгард обнаружил, что красный цвет придаёт крови вещество семейства под общим названием «альбумины» (от лат. albumen «(яичный) белый; красящий яйцо в белый цвет», нем. еiweisskörper «белковые тела»).
Это вещество содержало железо, а значит, молекулярная масса соединения должна была быть кратной атомной массе этого металла. Тогда такой вывод Энгельгарда вызвал насмешки и был назван «поспешным», но спустя 100 лет это предположение было полностью подтверждено. Кроме того, учёный установил, что отношение железа к остальной части молекулы у различных видов позвоночных одинаково.
В 1840 году ещё один немецкий физиолог и химик Фредерик Людвиг Хюнефельд в своей книге «Химизм в организации животных» подробно описывает процесс кроветворения, природу клеток крови и их ядер, и формулирует главное своё наблюдение, что красные кровяные тельца поглощают кислород. Хюнефельд понял, что вещество, красные остроугольные кристаллы которого в сухих препаратах крови он наблюдал под микроскопом, – это железосодержащий белок, вещество, описанное Иоганном Энгельгардом.
Другой немецкий химик, физиолог, основоположник современной биохимии и молекулярной биологии Эрнест Эммануэль Феликс Гоппе-Зейлер (1825-1895), с которым Фредерик Хюнефельд вместе работал в середине 1850-х годов в университете Грайсвальда, провёл детальное исследование кристаллических препаратов железосодержащего белка из эритроцитов с помощью уже известного к тому времени метода спектрального анализа.
Феликс Гоппе-Зейлер первый описал оптический спектр поглощения этого белка и показал наличие двух характерных полос, что указывает на присутствие в молекуле белковой части и небелковой (гема), в состав которой и входит железо. Именно гемовая часть белка отвечает за красный цвет крови, атом железа связывается с кислородом, более того, это связывание обратимо, то есть молекула гемоглобина может как присоединить молекулярный кислород, так и отщепить его.
Все эти открытия Феликса Гоппе-Зейлера подтвердили ранние предположения его коллег-соотечественников Энгельгарда и Хюнефельда о строении и функциях эритроцитарного белка. Его молекула имеет круглую форму, а такие белки объединены названием глобулины. Вот тогда Гоппе-Зейлер и назвал этот белок гемоглобин – гемсодержащий глобулин. Гемоглобин состоит из четырёх одинаковых субъединиц, каждая из которых содержит гем, то есть одна молекула имеет 4 кислород-связывающих участка.
Так вот оно что! В эритроцитах находится железосодержащий белок гемоглобин, который имеет красный цвет и обратимо связывает кислород воздуха! Это и есть одна из основных функций крови – перенос кислорода от дыхательных путей (лёгких) по кровеносным сосудам к остальным органам и тканям.
После того, как исследования Феликса Гоппе-Зейлера расставили точки над «i» в вопросе с функцией эритроцитов и гемоглобина как переносчика кислорода в организме, стало ясно, что анемия связана со снижением количества как этого белка, так и клеток, которые его содержат. А низкое содержание гемоглобина означает то, что клетки и ткани не получают достаточного количества кислорода, развивается гипоксия, и как следствие появляются утомляемость и слабость, а кожа и слизистая оболочка становятся бледными.
Встал вопрос о необходимости определять уровень гемоглобина в крови, позволяющий поставить диагноз «анемия». Метод определения этого показателя разработал английский врач Уильям Ричард Говерс в 1878 году. Кстати сказать, метод Говерса лежит в основе современного определения гемоглобина, только для этого используется автоматический прибор, и требуется всего несколько капель капиллярной крови.
Кроме того, к середине XIX века в крови были обнаружены белые клетки, лейкоциты (др.-греч. λευκός – белый) и кровяные пластинки, тромбоциты (от греч. θρόμβος – сгусток и κύτος – клетка; устаревшее название – кровяные пластинки), и учёные-исследователи крови пришли к одному очень важному выводу: при различных заболеваниях форма и количество красных и белых клеток крови меняются!
Итак, после этих открытий стало понятно, что кровь – это жидкая ткань организма, которая состоит из жидкой среды – плазмы (от греч. πλάσμα «нечто сформированное, образованное») и взвешенных в ней форменных элементов (лейкоцитов, эритроцитов и тромбоцитов).
Так сформировалась гематология – наука о заболеваниях крови, окончательный прорыв в этом осуществил уже известный нам по предыдущим историям немецкий учёный-биолог Пауль Эрлих (1854–1915), будущий Нобелевский лауреат, а на тот момент, в 1879 году, молодой 25-летний доктор медицины. Он разработал и опубликовал методику окрашивания плёнок крови и свой метод дифференциального подсчёта её клеток!
П. Эрлих создал первую теорию кроветворения, дуалистическую, согласно которой процесс образования клеток крови протекает в костном мозге (миелоидная система) и лимфе (лимфоидная система).
Что же такое кроветворная система и в чём её предназначение?
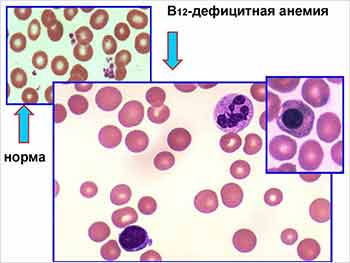
и при пернициозной анемии
Все клетки крови имеют своё ограниченное время жизни (от нескольких дней до нескольких месяцев), которое определяется функциями каждого их вида. Кроме того, по разным причинам возможны кровопотери. В связи с этим для поддержания нормального состояния крови необходимо её постоянное обновление – образование новых клеток. Такой процесс называется кроветворением или гемопоэзом, и он проходит в костном мозге, лимфатических узлах и селезёнке, трёх органах, объединённых в кроветворную систему (согласно современной унитарной теории кроветворения).
Процесс созревания эритроцитов, соответственно, имеет название эритропоэз и проходит в 9 этапов. Очень подробно мы это описывать не будем, скажем, только, что в результате прохождения всех стадий деления, преобразования и приобретения определённых признаков клетка-предшественник эритроцита предпоследнего этапа созревания в костном мозге – это очень крупная клетка круглой формы с ядром и рибосомами, в которой активно идёт синтез гемоглобина. Называется она мегалобласт (megaloblastus; megalo – большой + греч. blastos – росток, зародыш).
На следующем этапе клетка-зародыш избавляется от ядра и уменьшается в объёме в 10 раз, приобретает форму диска, превращаясь в ретикулоцит, раннюю форму эритроцита, которая выходит из костного мозга в кровяное русло.
Ретикулоцит уже не имеет ядра, но ещё содержит рибосомы в течение 1–2 суток после выхода из костного мозга, то есть способен продолжать синтезировать гемоглобин до тех пор, пока этим белком не будет заполнен весь внутренний объём клетки. После этого ретикулоцит избавляется от рибосом и становится, наконец, зрелым эритроцитом. Эритроциты имеют более насыщенный красный цвет по сравнению с ретикулоцитами, которые по окраске ближе к розовому цвету.
Отсутствие ядра и рибосом у зрелых красных кровяных клеток означает только одно – зрелые эритроциты не могут (и не должны) делиться и синтезировать белок, их задача связывать и разносить кислород в периферические ткани и органы, там его высвобождать, а присоединять и выводить углекислый газ – конечный продукт распада всех органических соединений.

Зная все эти особенности формирования зрелого эритроцита, врач имеет возможность после изучения окрашенного препарата крови пациента сделать вывод о его состоянии. И в случае присутствия в периферической крови ненормально крупных клеток с ядром и небольшим количеством гемоглобина (мегалобластов) ставится диагноз пернициозная или мегалобластная анемия.
Ну что же, опасного противника врачи теперь смогли узнать «в лицо», но он по-прежнему оставался смертельным. Методов лечения этой формы анемии так и не было найдено ещё долгие десятилетия до конца XIX и начала ХХ веков.
Но переломить ход этой смертельной партии всё-таки удалось, и случилось это в Соединённых Штатах Америки в 1920-х годах, когда вся мировая наука активизировалась после окончания Первой мировой войны, а одним из приоритетных направлений медицины стал поиск новых кровезаменителей и путей улучшения кроветворения в связи с массовой гибелью людей от кровопотерь во время военных действий и беспомощностью служб переливания крови того периода.

(1878–1976)
Первый важный вклад в победу над пернициозной анемией внесли трое американских учёных – Джордж Хойт Уиппл (1878–1976), Джордж Майнот (1885–1950) и Уильям Перри Мерфи (1892–1987). Этот этап, завершившийся присуждением Нобелевской премии по физиологии и медицине в 1934 году, заслуживает более детального описания. Итак...
Джордж Хойт Уиппл был талантливым и непревзойдённым врачом-патологом, организатором медицинских исследований, преподавателем и руководителем медицинского факультета сначала в Университете Джонса Хопкинса (Сан-Франциско, штат Калифорния), а затем в университете Рочестера (штат Нью-Йорк).
Во время командировки в Панаму сразу после получения диплома врача в 1908 году для борьбы с эпидемией чёрной лихорадки Джордж наблюдал массовый гемолиз (разрушение эритроцитов), сопровождавший это страшное заболевание, что оставило неизгладимое впечатление и побудило его всерьёз заняться гематологией.

(1892–1987)
Знания по этой дисциплине после возращения из командировки он шлифовал в Гейдельбергском университете (Германия), где освоил моделирование анемии на кроликах. Изучение процессов кроветворения стало для Уиппла приоритетом в его исследованиях на всю последующую жизнь.
Так, по возвращении в США, в Университете Джонса Хопкинса, Джордж Уиппл приступает к исследованию кроветворной системы у собак на модели острого отравления хлороформом. В серии этих экспериментов учёный обнаружил прямую связь между процессами свёртывания крови и функционированием печени.
Затем в 1914 году последовала работа по исследованию желтухи, болезни, которая сопровождается повышенным содержанием билирубина (жёлтый пигмент и составной компонент желчи) в крови и тканях, из-за чего кожа и слизистые оболочки окрашиваются в жёлтый цвет. Благодаря этим работам Уиппл и его коллега Чарлз Хупер в течение следующих 2 лет опубликовали 12 статей. И тогда мир узнал, что:
- билирубин является продуктом распада гема эритроцитов и миоглобина (белок с такими же функциями и строением, как и гемоглобин) в мышцах,
- для образования новых эритроцитов билирубин не используется,
- распад гема с образованием билирубина проходит в печени, а также в плевральной и брюшной полости.

и Джорджу Майноту вручают
Нобелевскую премию
Согласитесь, эти открытия сегодня уже стали фундаментальными знаниями медицины и физиологии. А тогда они позволили пролить свет на важность печени в процессах кроветворения. И тот факт, что в сыворотке крови больных пернициозной анемией наблюдалось повышенное содержание билирубина, ещё раз подтверждал, что при этом заболевании прогрессирует необратимый процесс разрушения эритроцитов с распадом гемоглобина, вследствие чего кожа и слизистые оболочки приобретают землисто-жёлтый оттенок, который так привлёк внимание Томаса Аддисона ещё в середине предыдущего столетия.
Но в карьере нашего героя наступил переломный момент, в 1921 году ему предложили работу по организации и последующему управлению медицинским факультетом в университете Рочестера.
На новом месте Дж. Уиппл продолжил работу по изучению проблем анемии. Для этого в моделях на собаках, у которых вызывалась хроническая анемия в результате обильных кровопотерь, группа под руководством Уиппла стала изучать влияние диет различного состава на процессы регенерации крови.
Среди компонентов пищи и лекарственных препаратов с возможностью влияния на синтез гемоглобина и кроветворение были использованы железосодержащие таблетки, хлеб, мясные продукты, и даже мышьяк и диоксид германия. Самым эффективным средством из этого списка оказалось, как вы думаете, что? Сырая говяжья печень!
Как это часто бывает, в гениальные открытия вмешивается Его Величество Случай (помните, как это было с открытием антиберийных свойств рисовой шелухи?). В этот раз произошло нечто подобное.
Уиппл после всех работ, о которых было рассказано выше, понял, что печень надо добавить в рацион собак с анемией для усиления регенерации крови. И животных стали кормить отварной печенью. Улучшения в показателях крови были заметными и превышали те, что были у животных, содержащихся на других рационах. Но вдруг через несколько дней произошёл резкий скачок уровня гемоглобина и количества эритроцитов у собак. Учёный был несказанно обрадован, но вместе с тем и удивлён, не понимая причины такой динамики.
Ответ был найден очень скоро и оказался следствием невероятно курьёзного случая. На должность лаборанта, отвечающего за приготовление пищи для собак, взяли нового сотрудника, оказавшегося жутко ленивым. Он просто поленился варить печень и кормил животных сырым продуктом!
В результате в 1925 году была опубликована серия статей под общим названием «Регенерация крови при тяжёлой анемии». Этими результатами заинтересовались двое других учёных, которые также, как и Джордж Уиппл, занимались поисками путей лечения анемии. Ими были Джордж Майнот и Уильям Перри Мерфи.
Джорж Майнот, потомственный врач, начал карьеру гематолога в 1913 году в Университете Джонса Хопкинса в Балтиморе (в то же время, когда там работал и Джордж Уиппл) в лаборатории знаменитого Уильяма Генри Хоуэлла, исследователя свёртываемости крови. А уже в следующем году предпринял первые попытки лечения пернициозной анемии.
В то время считалось, что одной из причин этого заболевания может быть нарушение работы селезёнки как кроветворного органа, и в качестве лечения предлагалось её удаление. Молодой врач пошёл этим путём, дававшим на какое-то время положительный эффект, о наличии которого он сделал вывод на основании микроскопического исследования крови своих пациентов.
После удаления селезёнки наблюдалось повышение количества ретикулоцитов в крови, то есть налицо была активация процессов кроветворения. Правда, через какое-то время картина вновь возвращалась к исходному состоянию.
Во время Первой мировой войны Майнот занимался лечением пациентов со специфической анемией – рабочих военных заводов, установив, что причиной болезни был контакт с тротилом.
Вновь к поискам средств лечения анемии Аддисона-Бирмера Дж. Майнот вернулся в 1921 году в Бостоне, где занимался изучением компонентов продуктов питания в рационе пациентов с этим диагнозом. Узнав о том, что его знакомый по Университету Джонса Хопкинса Джордж Уиппл смог вылечить анемию у собак с помощью сырой печени, Майнот загорелся идеей проверить эффективность этого метода у пациентов с неизлечимой формой анемии.
О возможности использовать специфическую диету для лечения фатального заболевания Майнота заставило задуматься ещё одно очень печальное событие. В 1921 году у нашего героя диагностировали сахарный диабет, и на тот момент единственным средством лечения этого заболевания была низкокалорийная диета.
Кстати, сказать, годом позже Ф. Дж. Бантинг и Чарльз Бест получили инсулин, и Джордж Майнот стал одним из первых пациентов, начавших принимать препараты этого гормона, чем смог сберечь своё здоровье и продлить жизнь, совершив небывалый прорыв в медицине.
Но вернёмся к пернициозной анемии. Незадолго до описываемых событий Майнот познакомился с ординатором Бостонского госпиталя Питера Бента Бригама Уильямом Мерфи, который в скором времени открыл ещё и частную практику. Среди пациентов Мерфи были те, у которых было диагностировано интересующее Майнота заболевание.
После детального изучения сути и перспектив нового метода лечения специфической диетой Мерфи без колебаний принял предложение Майнота и уговорил своих пациентов принять участие в рискованном эксперименте. Риск был вознаграждён, анализ крови больных после начала лечения сырой печенью неоднозначно говорил о радикальных сдвигах в течении болезни: регенерация эритроцитов имела устойчивую положительную динамику!
На собрании Ассоциации американских врачей в Бостоне 4 мая 1926 года Майнот и Мерфи описали свои результаты наблюдения 45 пациентов с пернициозной анемией, содержавшихся на высокобелковой диете от шести недель до двух лет. Ежедневный рацион больных включал 120–240 г сырой печени и 120 г мяса, что приводило к симптоматическому улучшению и росту числа эритроцитов.
На той же встрече Уильям Мерфи подробно рассказал о гематологических изменениях. В течение четырёх-десяти дней после начала диеты наблюдался рост образование ретикулоцитов в среднем с 1% до 8%, уменьшение желтухи за счёт снижения концентрации билирубина из-за восстановления динамического равновесия между образованием и разрушением эритроцитов, и, как главный итог – увеличение концентрации гемоглобина и количества красных клеток крови.
Наконец-то свершилось! Страшную болезнь с неизменным летальным исходом, уносившую ежегодно 6 тыс. жизней до этого переломного момента, удалось победить, обнаружен новый фактор пищи с антианемическим действием. После первых успехов и осторожных выводов Дж. Майнот и У. Мерфи продолжили официальные клинические исследования, которые подтвердили неоспоримый эффект нового подхода в лечении злокачественной анемии.
Но… Всегда в решении любой сложной проблемы есть хотя бы одно «но». Не обошлось без препятствия и в этом случае. Эффект давало лечение с использованием в рационе не менее полуфунта (226,8 г!!) сырой печени. Вы можете себе представить больного с описанными выше симптомами, среди которых страшная слабость, стойкая анорексия (неприятие пищи) и диарея, уплетающего за обе щеки сырую (или слабо обработанную термически) печень? Нет? Правильно делаете. Майноту и Мерфи приходилось прилагать особые усилия, чтобы уговорить, а порой и заставить, своих пациентов съедать «лекарство». Некоторым приходилось вводить его через зонд. Чего не сделаешь ради спасения жизни человека!
Итак, в сырой печени присутствует антианемический фактор, новый витамин. Как известно, следующим этапом в любой витаминной истории следует выделение этого вещества из природного источника. Джордж Майнот, который был учёным и исследователем в отличие от своего коллеги Мерфи, практикующего врача, занялся этим вопросом вплотную.
Самостоятельно он такую задачу решить был не в силах, поэтому стал активно искать специалиста в области физической химии белков и аминокислот, а конкретнее – их экстракции из биологических источников.
Выход был найден. Как раз в 1925 году вышла статья «Физические свойства белков» гарвардского специалиста Эдвина Джозефа Кона (1892–1953), в которой были изложены новаторские методы выделения белков, и Майнот обратился именно к нему за помощью.
За два года сотрудничества, в 1928 г., удалось получить экстракт говяжьей печени, в 50–100 раз эффективнее сырого продукта. Сухой препарат можно было использовать перорально (с питьем и едой) или внутримышечно. В начале 1930-х годов У. Мерфи показал, что одноразовое введение нового препарата, известного как «Фракция G», по действию равнозначно употреблению 11 фунтов сырой печени в течение нескольких недель.
Эдвин Кон продолжил работу с полученным экстрактом, пытаясь выделить в чистом состоянии искомый фактор, антианемический витамин. Но оказался бессилен. Тем не менее, несколько важных ходов в этой сложной партии со смертельной болезнью американский биохимик успешно выполнил!
Логическим завершением такого важного этапа стало награждение Джорджа Майнота, Уильяма Мерфи и Джорджа Уиппла Нобелевской премией по физиологии и медицине в 1934 году «за их открытия, касающиеся применения печени в лечении пернициозной анемии».
Всё! В опасной и затянувшейся почти на 100 лет партии поставлен шах и мат пернициозной анемии. Но история на этом не закончилась. Как нам уже известно из предыдущих рассказов, при обнаружении нового фактора пищи с важной биологической функцией требуются следующие этапы: выделение в чистом (кристаллическом) состоянии, расшифровка молекулярной структуры, а также синтез этого соединения. Эта часть пути была не менее важной и сложной.
Что же представляет собой жизненно важный компонент печени, и каким образом он влияет на кроветворение, в частности на эритропоэз?
Поиском ответов на эти вопросы занимался ещё одни гарвардский врач Уильям Босуворт Касл (1897–1987). В 1921 г., будучи молодым ординатором в Массачусетской больнице, он попал под влияние таланта Джорджа Майнота, который в то время работал там же и стал для молодых врачей образцом скрупулёзного исследователя тяжёлого недуга, пернициозной анемии. Изучение этой болезни для Касла стало основным направлением исследований на долгие годы.
Работа со всей доступной на то время литературой и наблюдения из собственной практики позволили молодому врачу примерно в 1929 году, когда уже были широко признаны открытия Дж. Майнота, У. Мерфи и Дж. Уиппла, сделать предположение о том, что в развитии данной патологии одно из центральных мест занимает желудочно-кишечный тракт. На эту мысль Касла натолкнуло то, что у пациентов с пернициозной анемией обнаруживалась низкая кислотность желудочного сока, а после резекции (удаления) желудка (полной или частичной) у онкологических больных лечение диетой с сырой печенью и бараниной не давало результата.

(1897–1987)
Кроме того, он знал, что при другом заболевании желудочно-кишечного тракта – спру – также нарушается процесс кроветворения, в частности эритропоэз (развивается мегалобластоз), но эта патология успешно лечится витамином В2.
У. Касл предположил следующую схему: антианемичный фактор вырабатывается или попадает с пищей в организм млекопитающих и человека, а затем депонируется в печени, после чего поступает в костный мозг, обеспечивая нормальный эритропоэз, тогда как у больных мегалобластной анемией это вещество в организме отсутствует. Но если больного кормить большим количеством сырой печени, можно полностью восполнить дефицит этого фактора и возобновить образование эритроцитов.
А поскольку у пациентов с болезнью Аддисона-Бирмера и нарушением функции желудочно-кишечного тракта введение пищевого антианемичного фактора, который Касл назвал внешним, не давало клинического эффекта, значит, у здоровых людей должен существовать ещё и «внутренний фактор», и только комбинация этих двух составляющих в организме – необходимое звено для поддержания нормального эритропоэза.
Чтобы доказать свою правоту, находчивый Уильям Касл прибег к очень экстравагантному эксперименту. Будучи человеком со здоровыми печенью и желудком, он съедал порцию сырой говяжьей печени, мясо говядины или баранины, после чего зондом собирал у себя желудочный сок и остатки непереваренного мяса. Затем самым отважным пациентам, очевидно считавшимся тогда безнадёжными, которых Касл смог уговорить пойти на такой риск, снова-таки через зонд вводили смесь из желудка самого доктора.
Через несколько дней у больных наблюдался активный ретикулоцитоз, считавшийся ранним подтверждением положительной динамики выздоровления. Введение только желудочного сока или только полупереваренного мяса или печени эффекта не давало.
Но вопрос с выделением в кристаллическом виде антианемического фактора продолжал оставаться открытым ещё несколько десятилетий, пока в 1948 году две независимые группы исследователей крупных и известных сегодня фармацевтических компаний – в Англии Glaxo (Эрнест Лестер Смит с сотрудниками) и Merck в США (Карл Огест Фолкерс с сотрудниками) – смогли завершить работу, начатую Эдвином Коном, и наконец-то получить кристаллические препараты неуловимого и мистического, но такого жизненно необходимого вещества из печени млекопитающих.
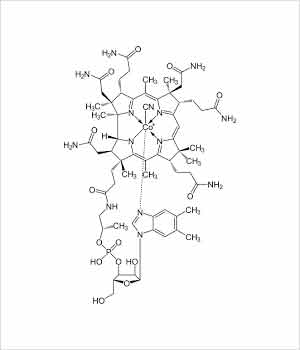
Детальные исследования обеими группами кристаллов красного цвета показали наличие в них циана, кобальта и аминогрупп. Как мы помним, аминосодержащие витамины объединены в группу В, и Карл Фолкерс, руководитель лаборатории компании Merck, даёт ему полное имя «витамин В12», или цианокобаламин.

А. Звеж (Медицинский Колледж
Нью-Йорка, 1972)
Гениальное предположение Уильяма Касла о существовании внутреннего фактора кроветворения подтвердилось в 1952 году, когда доктор медицины из медицинского колледжа Нью-Йорка Джордж Б. Ежи Гласс (1910–1982), американец польского происхождения, выделил из желудочного сока соединение, обладающее гемопоэтической активностью. Этим соединением оказался сложный белок гастромукопротеин, который вырабатывают железы слизистой оболочки желудка.
Именно этот белок соединяется в желудке с поступающим с пищей цианокобаламином, и только в таком комплексе витамин В12 может пройти кишечный барьер. В противном случае он будет уничтожен кишечной микрофлорой, что и происходит у людей с патологией желудка и, соответственно, дефицитом внутреннего фактора Касла.
Теперь учёные могли утверждать, что глубокий атрофический процесс слизистой желудка лежит в основе возникновения болезни Аддисона-Бирмера, или пернициозной анемии.
Если на этапе получения кристаллов цианокобаламина конкурирующие в изучении этого биологически активного соединения США и Англия так и не смогли поделить пальму первенства, то расшифровка структуры молекулы витамина В12 – полная заслуга британской школы биохимиков.
Для этого были объективные причины, ведущие специалисты структурной химии, которые использовали прогрессивную методику рентгеноструктурного анализа, находились в Оксфордском университете (Великобритания). Но надо отдать должное английским учёным, которые на определённых этапах решения этой архисложной задачи, завершившейся присуждением также Нобелевской премии, обращались за помощью к своим американским коллегам.
Красота и сложность процесса расстановки всех химических элементов и функциональных групп, входящих в состав молекулы цианокобаламина, заслуживают подробного описания.

(1910–1994)
Эрнест Лестер Смит, руководитель исследовательской лаборатории компании Glaxo, сразу после получения кристаллов витамина В12, понимая, что следующим логическим шагом должна быть расшифровка структуры молекулы, передаёт препарат Дороти Мери Кроуфут-Ходжкин (1910–1994), главному специалисту по кристаллографии с использованием рентгеновского излучения, сотруднице Оксфордского университета.
К 1948 году на счету этой незаурядной женщины-учёного была расшифровка структуры нескольких сложных соединений: холестерола, кальциферола (витамин Д3), пенициллина, гемоглобина и глобулинов растительного происхождения. Она ещё до начала Второй мировой войны приступила к работе над изучением строения молекулы инсулина, но вынуждена была её приостановить из-за необходимости провести такую же работу с пенициллином, важным антибактериальным веществом, от применения которого зависела жизнь многих раненых во время военных действий.
Открытие пенициллина Александром Флемингом и получение кристаллических препаратов этого антибиотика совместно с Эрнестом Б. Чейном и Хоуардом У. Флори также было отмечено Нобелевской премией по физиологии и медицине в 1945 году.
Расшифровка структуры молекул методом рентгеноструктурного анализа – это невероятно сложный, кропотливый, многоэтапный и длительный процесс, но работа с веществами, в состав молекул которых входили атомы металлов, значительно упрощалась, поскольку эти атомы являются самыми тяжёлыми в молекуле и их идентификация более простая в сравнении с анализом спектральной информации от остальных элементов. И это ноу-хау принадлежит Дороти Ходжкин. Поэтому, когда выяснилось, что в состав молекулы витамина В12 входит кобальт, работа сдвинулась с мёртвой точки, и дальнейшее исследование показало, что атом металла соединён с атомом углерода и порфириновым кольцом.
Так впервые была идентифицирована связь «углерод-металл» в металлоорганическом соединении.
Главной сложностью кристаллографического метода была математическая интерпретация полученных рентгеновских данных. Для этого использовались сложные расчёты и составление двумерных, а позже и трёхмерных карт молекулярных связей – рутинная и кропотливая работа, занимавшая огромное количество времени.
Дороти Ходжкин была единственной, кто использовал разработанные ею лично физические подходы, позволявшие сократить время расчётов без потери точности в определении всех компонентов и связей в молекуле вещества. Но в случае цианокобаламина всё оказалось гораздо сложнее. Приблизительное количество атомов было порядка 100, требовались точные сложные расчёты рентгеновских данных, облегчить которые стало возможно к середине 1950-х годов благодаря разработке и использованию первых электронно-вычислительных машин (ЭВМ).
Вот тут в партию вступают снова американские учёные, которым принадлежит создание первых мощных ЭВМ. Дороти Ходжкин обращается за помощью к таким специалистам как доктор Кеннет Трубланд из Калифорнии и Дэвид Крукшенк из Манчестера.
В определение структуры цианокобаламина также внёс значительный вклад выдающийся шотландский химик, Нобелевский лауреат по химии 1957 года «за роботу по нуклеотидам и нуклеотидным коэнзимам» Александер Робертус Тодд (1907–1997). Он проводил исследования химическими методами и в 1955 г. установил наличие отдельных компонентов и функциональных групп в молекуле этого соединения.
В 1956 году была закончена расшифровка структуры витамина В12, финальным числом атомов в которой оказалось 90. Признанием заслуг Дороти Ходжкин «за определение с помощью рентгеновских лучей структур биологически активных веществ» стало награждение её Нобелевской премией по химии в 1964 году.
При презентации член Шведской королевской академии наук Гуннар Хегг сказал: «Знание структуры соединения является абсолютно необходимым для того, чтобы интерпретировать его свойства и реакции и решать, каким образом его синтезировать из более простых соединений ... Определение структуры пенициллина было удивительным стартом новой эры кристаллографии ... Определение структуры витамина В12 – это триумф рентгеноструктурного анализа кристаллов с точки зрения химического и биологического значения результатов при большой сложности структуры».

Победным финишем многотрудного пути исследования сложного соединения, фактора пищи, дефицит которого является причиной злокачественной анемии, стал его направленный синтез для массового производства лечебных препаратов витамина В12. Этот ход был сделан вновь на Североамериканском континенте, в США, Робертом Бёрнсом Вудвортом (1917–1976) гением органического синтеза ХХ века, Нобелевским лауреатом по химии 1965 года.
Им было синтезировано много сложных природных соединений – хинин (1944), кортизон (1951), резерпин (1956), хлорофилл (1960), тетрациклин (1962), холестерин. Роберт Вудворт показал, что тщательное соблюдение принципов физической химии и детальное планирование этапов работы является основой синтеза любого природного продукта, а время расцвета его творчества вошло в историю науки как «Эпоха Вудворта».
Учитывая структуру молекулы витамина В12, которая является самой сложной из всех молекул витаминов и содержит корриновое кольцо (подобное порфириновому кольцу в молекуле гемоглобина), задача по выполнению синтеза этого соединения была такой же безумно сложной.
К её решению Роберт Вудворт с командой, состоящей более чем из 100 студентов и аспирантов, приступил в начале 1960-х годов. Работа проходила в сотрудничестве с коллегами из Цюриха (Швейцария) под руководством Альберта Эшенмозера, продолжалась несколько лет и завершилась в 1973 году победной публикацией результатов в специализированном издании Pure and Applied Chemistry.
Получив в своё распоряжение синтезированный витамин В12, учёные-биохимики приступили к тщательному исследованию его биологической роли. На сегодня нам известно, что этот витамин является коферментом двух типов биохимических реакций в организме, которые причастны к нескольким важным биологическим процессам.
Среди них: рост, нормальное кроветворение и созревание эритроцитов, работа нервной системы (образование холина, метионина, адреналина), синтез азотистых оснований нуклеиновых кислот и аминокислот белков. После этого стало понятно, почему одним из поздних симптомов пернициозной анемии являются нервные расстройства.
Также важным выводом учёных стало то, что биохимическая функция этого витамина тесно связана с фолиевой кислотой (витамин В9). Только тандем этих факторов поддерживает нормальное течение всех перечисленных процессов.
Интригующим открытием явился ещё один факт, касающийся удивительного витамина В12. Несмотря на то, что мы получаем его главным образом из продуктов животного происхождения (печень, мясо) и в гораздо меньшей степени из растений, тем не менее, сами животные, а также растения не синтезируют это вещество!
Как вы думаете, кому доверила природа такую важную задачу?? Ими оказались некоторые микроскопические грибы и микроорганизмы, составляющие здоровую микрофлору кишечника млекопитающих (в большей степени жвачных животных и меньше всего человека) и благодаря которым цианокобаламин в достаточном количестве накапливается в мышцах и печени этих животных. И уже потом с пищей попадает в наш организм.
Для поддержания работы здорового организма человека суточная доза витамина В12 составляет 3–10 мкг, а при лечении анемии необходимо вводить 100–150 мкг этого соединения в сутки.
Прочитав всё, что мы тут рассказали, вы догадываетесь, как много изучено и выяснено о витамине В12, но всё же остаются ещё механизмы его действия в организме, покрытые тайной…
Р.П. Виноградова, доктор биологических наук, профессор,
О.А. Гудкова, ведущий инженер,
Институт биохимии им. А.В. Палладина НАН Украины
По теме:
| Братья по крови |
| Витамин C: гонка за лидером |
| Витаминный алфавит |
| Загадка бери-бери |
| Витамины: начало пути |










 Основатель и издатель
Основатель и издатель Copyright © 2016–2021 Научно-популярный
Copyright © 2016–2021 Научно-популярный