
Грип епідеміологи відносять до найбільш масових респіраторних вірусних інфекцій, яким властива тенденція до швидкого епідеміологічного поширення і дуже часто – тяжкий перебіг, обумовлений розвитком ускладнень, загостренням супутніх захворювань.
Збудниками грипозної інфекції є віруси типу А, В, С із сімейства Ortomixoviridae.
Найбільш поширений в природі вірус грипу А: він вражає людей, ссавців і птахів, які є його природними носіями, що забезпечує збереження вірусу в міжепідемічний період і сприяє його стрімкому поширенню.
Вчені виділяють різні штами вірусу грипу, які утворюються в результаті властивої йому підвищеної мінливості. Вірус A/H1N1 викликає пандемії – повальні епідемії, що охоплюють населення значної частини країни, ряду країн, цілих континентів. Це – сумнозвісна «іспанка» 1918-1919 років, а остання зафіксована пандемія «свинячого грипу» була в 2009-2010 році. Цілком реальна загроза появи нових небезпечних субтипів «свинячого» і «пташиного» походження, таких як H5N1, H7N9, H9N2, H2N2, для яких характерне стрімке поширення, специфічна симптоматика, важкий перебіг, часто з летальним наслідком.
Все це вимагає детального вивчення причин і закономірностей виникнення пандемій, властивостей вірусів, закономірностей формування їх нових штамів, а також удосконалення вакцин і лікарських препаратів.
Звичайно, в організмі людини для захисту від вірусів виробляється інтерферон – універсальний антивірусний глікопептид, що активує імунну відповідь, в тому числі й на інфікування будь-яким штамом вірусу грипу.
Але дуже часто його недостатньо: інтерферонова відповідь короткочасна, а у частини населення – знижена або навіть відсутня (внаслідок пригнічення імунітету, викликаного недоїданням чи неправильним харчуванням, хронічними стресами).
Крім того, пригнічувати продукцію інтерферону в організмі можуть і самі віруси. У таких випадках для лікування використовують препарати рекомбінантних інтерферонів, які тимчасово можуть замістити дефіцит інтерферону в організмі.
Згідно із вимогами ВООЗ лікування вірусних інфекцій передбачає використання лікарських засобів, дія яких спрямована на конкретного збудника – так званих етіотропних антивірусних препаратів. Такі препарати для лікування грипу пошкоджують/інактивують специфічні компоненти вірусу (рис. 1А) та ефективні на початкових стадіях інфекційного процесу. Арбідол взаємодіє з гемаглютиніном вірусів грипу, пригнічуючи вивільнення вірусної нуклеїнової кислоти і розмноження вірусу.
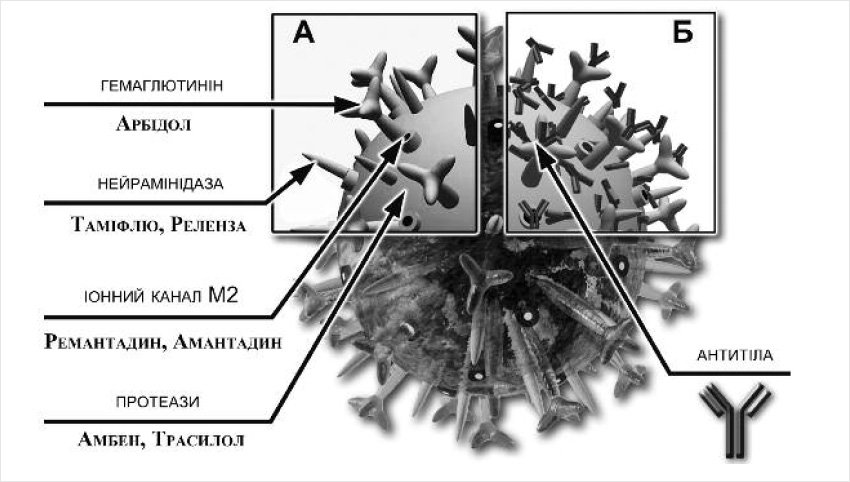
Реленза (занамівір) і Таміфлю (озельтамівір) – пригнічують функцію вірусного ферменту нейрамінідази у вірусів грипу А або В, ускладнюючи вихід новосинтезованих вірусів з клітин та їх поширення в організмі.
М2 білок вірусу грипу А, який відіграє ключову роль на ранніх стадіях вірусної інфекції, а також впливає на інфекційність новосинтезованих вірусів на пізніх стадіях вірусної репродукції – мішень для препаратів Ремантадин і Амантадин, які блокують його дію.
Амбен, Трасилол та інші інгібітори протеаз пригнічують розщеплення внутрішньоклітинними протеазами гемаглютиніну на поверхні вірусу грипу, не допускаючи, таким чином, його активації та ініціації інфекційного процесу.
Незважаючи на великий арсенал хіміопрепаратів, які пригнічують репродукцію вірусів грипу, вони далеко не завжди здатні захистити від інфекції. І це закономірно, оскільки використання етіотропних антивірусних засобів, які діють на вузько специфічну, конкретну ланку в процесі розмноження вірусу, супроводжується відбором стійких до такого впливу штамів, внаслідок чого вже після одного сезону застосування високоспецифічних препаратів частота виявлення резистентних до них штамів серед клінічних ізолятів складає від 5 до 40 відсотків.
З метою специфічної профілактики грипу рекомендується застосовувати вакцинацію, особливо в групах ризику: людям старшого віку, дорослим і дітям з хронічними захворюваннями дихальної, серцево-судинної системи, хворим на бронхіальну астму, цукровий діабет, із хворобами нирок, імунодефіцитними станами та ін.
Протигрипозна вакцина може містити цілі віріони або фрагменти одного (моновалентна) або декількох (полівалентна) підтипів вірусу. Але оскільки в епідемічний сезон циркулює не один штам вірусу, а переважно кілька, зараз для вакцинопрофілактики розроблені та використовуються комплексні вакцини, які мають в своєму складі антигени до всіх штамів, які очікуються в поточному сезоні.
Введення такої вакцини активує імунну відповідь організму відразу на всі її складові: виробляються антитіла, здатні нейтралізувати поверхневі антигени (гемаглютинін і нейрамінідазу) та інші структурні компоненти всіх включених у вакцину штамів вірусів грипу (рис. 1Б).
Позитивні якості вакцини (здатність формувати імунітет до вірусу) об’єднані поняттям «імуногенність», а негативні (побічні реакції після імунізації) – поняттям «реактогенність»; співвідношення цих показників визначає якість вакцини (ефективність і безпеку).
Залежно від способу обробки вірусного матеріалу при створенні вакцин розрізняють кілька типів антивірусних вакцин (рис. 2).
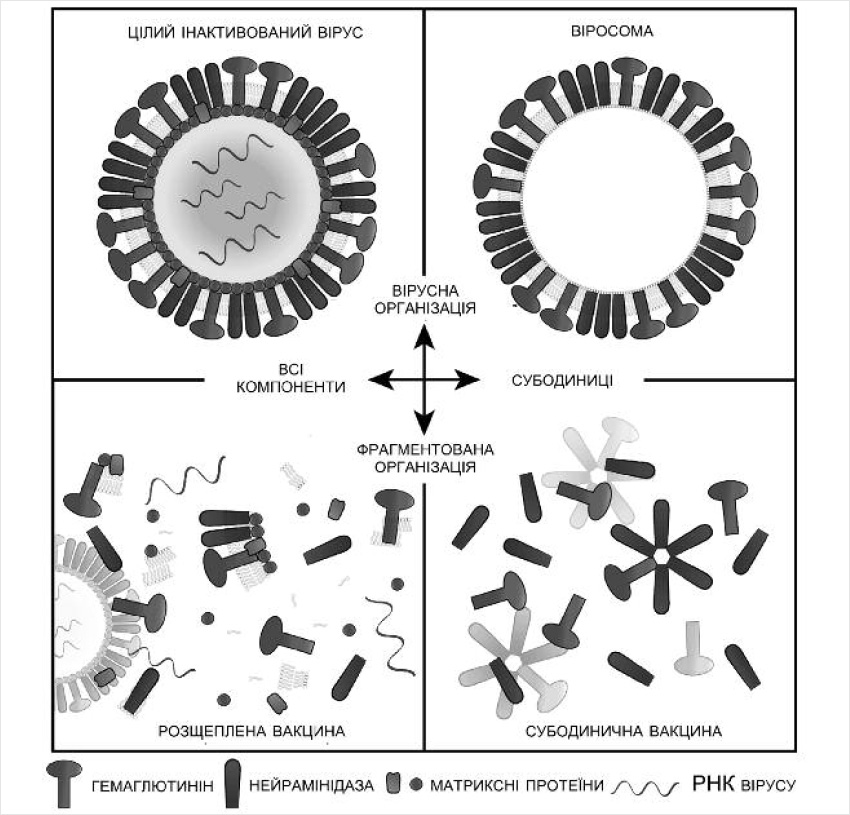
У складі суцільновіріонних вакцин присутні цілі інактивовані віруси. Застосування таких вакцин викликає хорошу імунну відповідь, але супроводжується великою кількістю побічних реакцій (особливо у маленьких дітей). Розщеплені або сплітвакцини містять зруйновані інактивовані віріони вірусу грипу. В їх складі – всі віріонні білки: не тільки поверхневі, але і внутрішні антигени. Імуногенність суцільновіріонних та розщеплених вакцин практично однакова, але реактогенність останніх нижча.
Саме полівалентні розщеплені спліт-вакцини – наприклад, Ваксігрип/Fluzone чи Fluarix сьогодні застосовують найбільш масово. Найменш реактогенні субодиничні вакцини (Інфлувак, Грипол, Агриппал), до складу яких входять лише два найбільш важливих для індукції антигрипозної імунної відповіді поверхневих вірусних білка: гемаглютинін і нейрамінідаза. Але такі вакцини – найменш ефективні.
В якості допоміжних речовин до складу вакцин можуть входити консерванти, буферні компоненти і підсилювачі імунної відповіді (так звані ад’юванти). Ад’юванти специфічно впливають на імунну систему та посилюють імуногенність вакцин, але самі можуть викликати побічні реакції. Тобто існуючі ад’юванти підвищують реактогенність вакцин.
Недавно навіть з’явився термін ASIA – аутоімунний запальний синдром, викликаний ад’ювантами. Найбільш часті прояви цього синдрому – лихоманка, біль у суглобах, дерматоз, слабкість і біль у м’язах.
Останні розробки – це віросомальні вакцини, вакцини четвертого покоління. Технологія їх виробництва передбачає використання полімерних наночастинок і/або поверхнево-активних речовин (фосфоліпідів) із фрагментів вірусу для формування віросом – вірусоподібних наночастинок (рисунок 2).
Наприклад, у складі віросомальної вакцини Ультрікс
– організований у вірусоподібні частки інактивований віросомальний комплекс, який містить поверхневі та внутрішні антигени вірусу грипу. Віросомальні вакцини відрізняються низькою реактогенністю та високою імуногенністю, тривалим напруженим імунітетом і можуть застосовуватися без обмежень для імунізації дітей і людей літнього віку.
Крім застосування наночастинок в складі вакцин як носіїв білків і антигенів, їх застосовують і з метою підвищення імуногенності як ад’ювантів і/або імуностимуляторів. Прикладом таких ад’ювантів можуть бути глобули ліпополісахаридів або наночастинки сполук алюмінію: недавно фірма Sanofi Pasteur (виробник вакцини Ваксигрип) запатентувала композицію, що містить наночастинки гідроксиду алюмінію, стабілізовані поліакриловою кислотою.
Як наноад’юванти застосовують масляні емульсії, частинки різної полімерної природи, порожнисті сферичні бульбашки, вкриті різними бімолекулярними фосфоліпідами та холестериновими плівками (ліпосоми), а також матриксні наносфери і везикулярні нанокапсули. Відомо, що як наноад’юванти використовують також похідні фулерену чи наночастинки благородних металів.
Завдяки унікальному комплексу фізико-хімічних властивостей до числа перспективних нанобіоматеріалів належить нанокристалічний діоксид церію, який має цілий спектр надзвичайно цікавих біологічних ефектів.
Одна із ключових властивостей наночастинок діоксиду церію – це їх здатність інактивувати активні форми кисню і перешкоджати окислювальному стресу. Такі властивості наночастинок діоксиду церію дозволяють розглядати можливість їх безпечного застосування в складі вакцин як ад’ювантів, які не викликають формування аутоімунного синдрому ASIA.
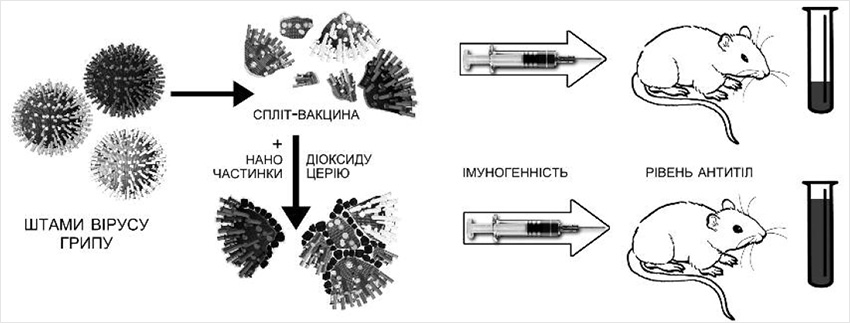
У зв’язку з цим, вчені ІМВ ім. Д.К. Заболотного НАНУ, ДБУН ІЗНХ ім С.М. Курнакова РАН та ДУ ІЕІХ ім. Л.В. Громашевського НАМНУ дослідили імуногенність антигрипозної вакцини, модифікованої наночастинками діоксиду церію.
Дослідження проводили на прикладі трьохвалентної спліт-вакцини Ваксігрип (Sanofi Pasteur, Франція), до складу якої входять інактивовані розщеплені віруси A/H1N1 і A/H3N2, а також вірус грипу B. Вакцину модифікували додаванням наночастинок діоксиду церію розміром 2-6 нм.
Дослідження імуногенності такої модифікованої вакцини проводили на білих безпородних мишах. Результати досліджень колективу вчених будуть опубліковані в березневому (2016 р.) номері авторитетного журналу Antiviral Research.
Виявилось, що у тварин, імунізованих немодифікованою вакциною, кількість антитіл до вірусів грипу A/H1N1 і A/H3N2 збільшувалась у чотири рази, тоді як рівень антитіл до вірусу грипу В не відрізнявся від невакцинованих тварин. Тобто, якщо в умовах проведеного експерименту імуногенність вакцини Ваксігрип до вірусів грипу А відповідала вимогам Європейського комітету до протигрипозних вакцин, то для вірусу грипу В – ні.
У групи мишей, які отримували вакцину, модифіковану наночастинками діоксиду церію виявлено істотний приріст титрів антитіл до всіх вірусів, які входять до складу вакцини.
До вірусів грипу A/H1N1 і A/H3N2 приріст титрів антитіл був восьмикратним, а до низько імуногенних вірусів грипу В – чотирикратним! (рис. 3)
Цікаво, що модифікування вакцини наночастинками не тільки не приводило до підвищення її реактогенності, але й збільшувало тривалість циркуляції антитіл у крові імунізованих тварин.
Оскільки наночастинки CeO2 не є імуногенними, очевидно, що виявлений факт підвищення імуногенності модифікованої антигрипозної спліт-вакцини, обумовлений впливом наночастинок на її структурні компоненти.

А – ТЕМ мікрофотографія вакцини Ваксігрип
після взаємодії з наночастинками
діоксиду церію,
Б – модель взаємодії вірусних компонентів
вакцини і наночастинок діоксиду церію
Причину такої цікавої комплексної імунної відповіді вчені зрозуміли, коли дослідили модифіковану та немодифіковану вакцину більш уважно, в тому числі, за допомогою електронної мікроскопії (рисунок 4).
Відомо, що у складі вакцини Ваксігрип – невпорядкований набір фрагментів вірусів. У той же час, введення до її складу наночастинок діоксиду церію призводить до адсорбції останніх на вірусних компонентах та формування більш великих часток, що містять фрагменти різних вірусів.
Розроблений метод модифікації вакцин простий та економічний: він не потребує принципових технологічних змін в їх виробництві.
Для отримання модифікованої вакцини достатньо ввести в певному співвідношенні до її складу наночастинки діоксиду церію.
Подібно Франкенштейну, зібраному з фрагментів різних тіл, такі збірні компоненти вакцини, що складаються з фрагментів вірусів грипу і наночастинок, стали «агресивнішими»: вони більш ефективно і тривало активують імунну відповідь організму, забезпечуючи його повноцінний захист відразу від трьох штамів вірусів грипу.
Такі модифіковані вакцини викликають збільшення титрів антитіл до всіх антигенів в їх складі, в тому числі і антигенів низькоімуногенного вірусу грипу В. Виявлений факт вимагає подальшого поглибленого вивчення; але, тим не менш, можна однозначно стверджувати, що здійснена вченими успішна спроба модифікації антигрипозної вакцини свідчить про перспективність запропонованого способу підвищення специфічної активності вакцин із застосуванням наноконструкцій на основі наночастинок діоксиду церію, особливо в умовах регулярних епідемій грипу.
Звичайно, науковці постійно знаходяться у пошуку шляхів і способів кращого захисту організму від респіра-торних вірусних інфекцій. Але потрібно пам’ятати, що найкращий захист для кожного із нас – це здоровий організм, тренована імунна система, правильний спосіб життя.
Тільки вони є запорукою того, що у відповідь на введення вакцини у Вас буде сформована сильна імунна реакція, а якщо Вам поставлять діагноз ГРВІ, то застосування антивірусних препаратів забезпечить швидке одужання.
Що почитати:
- Щербаков А.Б., Жолобак Н.М., Иванов В.К., Третьяков Ю.Д., Спивак Н.Я. Наноматериалы на основе диоксида церия: свойства и перспективы использования в биологии и медицине // Бiотехнологія. 2011; 4(1),
- Иванов В.К., Щербаков А.Б., Жолобак Н.М. Щедрый дар Цереры. // Химия и жизнь. 2012, №5
Словничок термінів
- ВООЗ
- – Всесвітня організація охорони здоров’я
- ГРВІ
- – гострі респіраторні вірусні інфекції – сезонні вірусні захворювання, що викликаються цілим спектром найрізноманітніших вірусів, «вхідними воротами» для яких в організмі є верхні дихальні шляхи.
- Інтерферон
- – універсальний антивірусний глікопептид, що синтезується в організмі хребетних тварин і людини у відповідь на вірусне інфікування чи застосування речовин – індукторів інтерферону: дволанцюгових рибонуклеїнових кислот, низькомолекулярних сполук синтетичного чи природного походження.
- Ад’юванти
- – синтетичні чи природні речовини – штучні підсилювачі імунної відповіді
- ASIA
- (autoimmune/inflammatory syndrome induced by adjuvants) – патологічний запальний синдром, зумовлений запуском продукції антитіл проти здорових, нормальних тканин, викликаний ад’ювантами.
- Імуногенність
- – здатність речовини, вакцини викликати імунну реакцію в організмі у відповідь на її введення
- Реактогенність
- – негативні, побічні реакції організму після введення речовин, що стимулюють імунну відповідь.
Н.М. Жолобак, кандидат біологічних наук,
О.Б. Щербаков, кандидат хімічних наук, Інститут мікробіології і вірусології ім. Д. К. Заболотного НАН України
В.К.Іванов, доктор хімічних наук, Інститут загальної і неорганічної хімії ім. М.С. Курнакова РАН
















 Засновник та видавець
Засновник та видавець