Цей газ був відкритий ще в XVII столітті голландським ученим К. Дреббелем (1572-1633). Він використовував кисень для дихання у підводному човні власної конструкції. Але це відкриття стосувалося військової техніки і трималося в секреті, тому ніяк не вплинуло на подальші дослідження.
Першовідкривачами кисню вважаються шведський аптекар Карл Шеєле (1742-1786) і англійський священик Джозеф Прістлі (1733-1804). Протягом багатьох років Карл Шеєле вивчав розкладання нагріванням безлічі речовин (серед яких була і селітра KNO3) і отримав газ, який підтримував дихання і горіння. Свої дослідження він опублікував у 1777 році в книзі «Хімічний трактат про повітря і вогонь».
Джозеф Прістлі додатково вивчав «пневмохімію», тобто властивості різних газів. Серед речовин, розкладання яких він дослідив, виявилася одна, відома ще алхімікам під назвою «Меркуріус кальцінатус провсе» або палена ртуть (оксид ртуті).
Рівняння його розкладання при нагріванні виглядає наступним чином: 2HgO = 2Hg + O2.
Свій досвід Прістлі описав у 1774 році таким чином: «Я помістив під перевернуту банку, занурену в ртуть, трохи порошку «меркуріус кальцінатус пров се». Потім я взяв невелике запальне скло і направив промені сонця прямо всередину банки, на порошок. З порошку стало виділятися повітря, що витиснуло ртуть з банки. Я почав вивчати це повітря. І мене здивувало, навіть схвилювало до глибини моєї душі, що в цьому повітрі свічка горить краще і світліше, ніж у звичайній атмосфері».
Зрозуміло, такий опис реакції виглядає дуже поетично в порівнянні зі звичайним хімічним рівнянням.
Кисень у промислових кількостях отримують з рідкого повітря, охолодженого до температури мінус 200 °С. Рідкий азот кипить при мінус 196 °С, а кисень при мінус 183 °С. У процесі нагрівання рідкого повітря спочатку випаровується азот, і тільки потім – кисень, який зберігають у стислому вигляді в сталевих балонах блакитного кольору.
У лабораторії кисень отримують нагріванням таких речовин, як перманганат калію (марганцівка), хлорат калію (бертолетова сіль), нітрат калію (селітра).
На сьогодні випускаються спеціальні апарати, «кисневі концентратори», в яких повітря пропускається через мембрани або фільтри, де затримується азот, і очищений до 95% кисень надходить на вихід.
Незважаючи на велику різноманітність джерел кисню, все ще існує потреба у більш автономних і дешевих приладах.
У ресторанному меню – кисень. Як не дивно, але випадків використання джерела кисню як додаткової послуги в барах, ресторанах, косметичних салонах з кожним роком стає все більше і більше.
Наприклад, в Японії відкрився бар «Киснева підтримка», де відвідувач з чашкою кави може замовити маску і каністру з киснем. Як стверджують фахівці, вдихання кисню дозволяє досить ефективно скинути накопичену за день втому і підвищити життєвий тонус.
Крім барів розвивається і мережа масажних салонів, що пропонують клієнтам релаксаційний курс кисневої терапії. Користуються киснем для відновлення сил і спортсмени. Тренери професійної бейсбольної команди «Якулта» наполягають, щоб перед виходом на поле спортсмени вдихали повітря, збагачене на 30%-40% киснем. Як показала річна практика, є позитивні результати такої «розминки».
Баночки з киснем все частіше надходять в торговельні мережі, продаються в інтернет-магазинах і навіть на вулицях. У Пекіні можна купити у вуличних торговців баночку з чистим повітрям. Півлітрові банки з киснем об’ємом до 7 л., що зберігається у них під тиском, пропонуються на світових інтернет-сайтах. Мережа супермаркетів Seven-Eleven оголосила про надходження в продаж «баночного кисню». Продукт орієнтований на споживачів, втомлених від міського смогу, таких, наприклад, як офісні працівники і водії. Баночний кисень допоможе їм подолати втому і стрес.
Кисень необхідний і для відновлення фізичних сил людини, і як «технічний» засіб у побуті, косметичних салонах, різних лабораторіях, медичних кабінетах.
Зручно отримувати кисень з перекису водню в присутності каталізатора, наприклад, діоксиду мангану (MnO2), деревного вугілля (вуглець), залізного порошку, але для отримання «побутового» кисню такий підхід не вживають.

студент МАН Богуслав Шандренко,
науковий співробітник Неллі Латишко
Я працював в Малій академії наук на базі Інституту біохімії ім. О.В. Палладіна НАНУ спільно з науковим співробітником Неллі Латишко і інженером Ольгою Гудковою. Ми вирішили використовувати для отримання кисню каталазу – фермент, який розкладає перекис водню на воду і молекулярний кисень: 2H2O2 = 2H2O + O2.
Каталаза є одним з найбільш швидкодіючих ферментів: одна молекула каталази здатна в секунду розкласти кілька мільйонів молекул перекису водню на воду і кисень. Вона застосовується в процесах утилізації залишкових кількостей перекису водню в різних технологіях легкої, хімічної та харчової промисловості. Найбільш широко фермент застосовується в технології відбілювання бавовни при виробництві текстилю. У харчовій промисловості каталаза застосовується для холодної стерилізації пива, напоїв, молочних продуктів.
Перекис водню, Н2О2 – нестійка хімічна сполука, яка здатна спонтанно розпадатися з виділенням кисню та утворенням води. У біологічних системах вона є токсичною, оскільки може викликати утворення вільних радикалів. Н2О2 нейтралізується за допомогою спеціальних ферментів, у тому числі каталази.
Водний розчин перекису водню застосовують для відбілювання тканин, вовни, знебарвлення волосся, консервації, дезінфекції. У медицині розчин перекису водню (зазвичай 3%) застосовують як антисептичний засіб при обробці подряпин і дрібних ран. Потрапивши на подряпину або ранку, перекис починає виділяти кисень – сильно шипить і утворює бульбашки на поверхні шкіри.
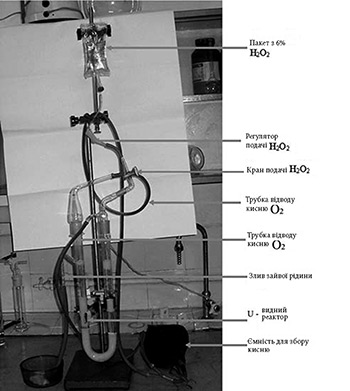
Наша ідея полягає у створенні спеціального автономного апарату для одержання кисню із застосуванням каталази і перекису водню.
В якості реактора застосовується скляна колонка U-подібної форми (V = 200 мл), яка заповнюється препаратом каталази у зв’язаній формі (30 мл). Розчин перекису водню (6%) подається з резервуара, з’єднаного з колонкою за допомогою трубки з краном і регулятором для зміни швидкості подачі цього субстрату. Відвідна трубка з іншого боку колонки призначена для зливу води, що утворюється в реакції.
Кисень збирають у спеціальну посудину з обох отворів колонки. Така форма реактора дає можливість повного розкладання вихідної кількості перекису водню препаратом каталази.
Достатня кількість рідини запобігає перевищенню температури усередині системи, оскільки реакція є екзотермічною. За необхідності, допускається використання зовнішньої охолоджувальної ванночки.
Ця конструкція реактора дозволяє багаторазово використовувати препарат ферменту. Швидкість виділення кисню залежить від швидкості подачі розчину перекису водню.
В якості носія для іммобілізації каталази пропонується використовувати селективні іоніти, наприклад, слабо основний аніоніт АНС, АН-31 (ДСТ 20301-74). Перевага застосування даного носія для зв’язування ферменту полягає в тому, що ця слабо основна макропориста аніонообмінна смола фізично, хімічно, термостабільна і екологічно безпечна. Вона використовується для водопідготовки та водоочищення.
Скільки кисню можна одержати з 1 л 6% перекису водню?
1 літр 6% H2O2 – містить 60 г H2O2. Молекулярна вага M [H2O2] = 34 г/моль. Тому, 1 літр 6% H2O2 містить приблизно 2 моля речовини. У реакції отримуємо в 2 рази менше кисню, ніж було введено перекису: 2H2O2=2H2О+O2.
Відповідь: з 1 літра 6% H2O2 можна отримати 1 моль О2, приблизно 20 л газу.
Таким чином, даний метод є перспективним для отримання невеликих обсягів чистого кисню для різних сфер життєдіяльності людини.
Богуслав Шандренко, студент МАН, учень 10-Д класу гімназії «Троєщина», м.Київ

















 Засновник та видавець
Засновник та видавець